
分析 (1)依据C=$\frac{1000ρω}{M}$计算浓硫酸的物质的量浓度;依据溶液稀释过程中溶质的物质的量不变计算需要浓硫酸的体积;
(2)依据需要浓硫酸体积,结合“大而近”原则选择量筒规格;量取时发现量筒不干净,用水洗净后直接量取,导致量取浓硫酸浓度偏低,依据c=$\frac{n}{V}$进行误差分析;
(3)依据浓硫酸稀释产生大量的热解答;
(4)依据容量瓶构造及转移液体的正确操作解答;
(5)依据定容的正确操作解答.
解答 解:(1)98%的浓H2SO4(ρ=1.84g/cm3)物质的量浓度C=$\frac{1000×1.84×98%}{98}$=18.4mol/L;设需要浓硫酸体积为V,则据溶液稀释过程中溶质的物质的量不变得,0.5mol/L×500mL=18.4mol/L×V,解得V=13.6mL;
故答案为:18.4,13.6;
(2)依据(1)可知需要浓硫酸体积13.6mL,应选择15mL量筒;量取时发现量筒不干净,用水洗净后直接量取,导致量取浓硫酸浓度偏低,所含溶质硫酸的物质的量偏小,依据c=$\frac{n}{V}$可知,所配溶液浓度偏低;
故答案为:15,偏低;
(3)浓硫酸稀释产生大量的热,所以将量取的浓H2SO4沿烧杯内壁慢慢注入盛有约100mL水的里,并不断搅拌,目的是加快散热;
故答案为:加快散热;
(4)容量瓶瓶颈较细,为防止液体洒落到容量瓶外边,应将冷却至室温的上述溶液沿玻璃棒注入500mL容量瓶,并用50mL蒸馏水洗涤烧杯2~3次,洗涤液要转入500mL容量瓶中;
故答案为:玻璃棒,500mL容量瓶,转入500mL容量瓶;
(5)定容的正确操作,向容量瓶中加水至距刻度2-3cm处,改用胶头滴管加水,使溶液的凹液面正好跟刻度相平;
故答案为:2-3厘米,胶头滴管.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理,熟悉操作步骤是解题关键,注意容量瓶构造及使用方法,注意浓硫酸稀释的正确操作解答.


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铁片和稀硫酸反应制取氢气时,改用 98%的浓硫酸可以加快产生氢气的速率 | |
| B. | 100mL2mol•L-1 的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变 | |
| C. | SO2 的催化氧化是一个放热的反应,所以升高温度,反应速率减慢 | |
| D. | 汽车尾气中的 NO 和 CO 可以缓慢反应生成 N2 和 CO2,减小压强反应速率减慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与稀硝酸反应:Fe+2H+═Fe2++H2↑ | |
| B. | 氢氧化铁溶液与盐酸反应:OH-+H+═H2O | |
| C. | 锌与硫酸铜溶液反应:Zn+Cu2+═Zn2++Cu | |
| D. | 氢氧化钡溶液与稀硫酸反应:H++SO42-+OH-+Ba2+═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6gFe在氧气中燃烧,完全反应时转移电子数为0.3NA | |
| B. | 标准状况下,4.48L氦气中所含原子数为0.2NA | |
| C. | NA个Fe(OH)3胶体粒子的质量为107g | |
| D. | 带温下,l.7gNH3和3.65gHCl混合后,气体分子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
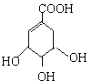 (提示:环丁烷
(提示:环丁烷 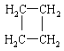 可简写成□)
可简写成□)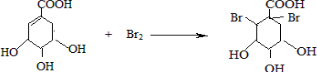 ,
,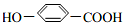 ),其反应类型是消去反应,
),其反应类型是消去反应,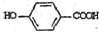 +2Br2→
+2Br2→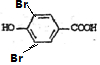 +2HBr.
+2HBr.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同物质的量浓度的NaA、HA混合溶液呈碱性 | |
| B. | 提高CO2兖气压力,碳酸饮料中c (A-)减小 | |
| C. | 当碳酸饮料的pH为5.0时,$\frac{c(HA)}{c({A}^{-})}$=0.16 | |
| D. | 碳酸饮料中各粒子的浓度关系为c( H+)=c( HCO3-)+2c( CO32-)+c(OH-)-c(HA) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 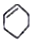 属于芳香族化合物 属于芳香族化合物 | B. | 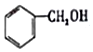 属于酚类化合物 属于酚类化合物 | ||
| C. | 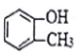 属于脂环化合物 属于脂环化合物 | D. | CH3CH2CH(CH3)2属于链状化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com