
【题目】用软锰矿![]() 主要成分为
主要成分为![]() 生产高锰酸钾产生的锰泥中,还含有
生产高锰酸钾产生的锰泥中,还含有![]() 的
的![]() 、
、![]() 的
的![]() 均为质量分数
均为质量分数![]() ,及少量Cu、Pb的化合物等,用锰泥可回收制取
,及少量Cu、Pb的化合物等,用锰泥可回收制取![]() ,过程如图:
,过程如图:
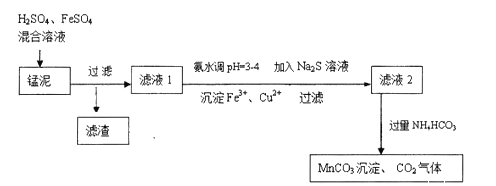
![]() 高锰酸钾的氧化性强弱与溶液的酸碱性有关,在酸性条件下其氧化性较强,通常用来酸化高锰酸钾的酸是 ______ .
高锰酸钾的氧化性强弱与溶液的酸碱性有关,在酸性条件下其氧化性较强,通常用来酸化高锰酸钾的酸是 ______ .
![]() 除去滤液1中
除去滤液1中![]() 的离子方程式是 ______ .
的离子方程式是 ______ .
![]() 经实验证明:
经实验证明:![]() 稍过量时,起始
稍过量时,起始![]() 、
、![]() 混合溶液中
混合溶液中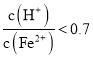 时,滤液1中能够检验出有
时,滤液1中能够检验出有![]() ;
;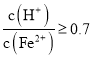 时,滤液1中不能检验出有
时,滤液1中不能检验出有![]() 根据上述信息回答①②③:
根据上述信息回答①②③:
①检验![]() 是否氧化完全的实验操作是 ______ .
是否氧化完全的实验操作是 ______ .
②生产时![]() 、
、![]() 混合溶液中
混合溶液中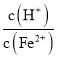 应控制在
应控制在![]() 之间,不宜过大,请结合后续操作从节约药品的角度分析,原因是 ______ .
之间,不宜过大,请结合后续操作从节约药品的角度分析,原因是 ______ .
③若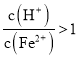 ,调节
,调节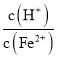 到
到![]() 的最理想试剂是 ______
的最理想试剂是 ______ ![]() 填序号
填序号![]()
![]() 溶液
溶液 ![]() 铁粉
铁粉 ![]()
![]() 写出滤液2中加入过量
写出滤液2中加入过量![]() 反应的离子方程式: ______ .
反应的离子方程式: ______ .
![]() 上述过程锰回收率可达
上述过程锰回收率可达![]() ,若处理1740kg的锰泥,可生产
,若处理1740kg的锰泥,可生产![]() ______ kg.
______ kg.
【答案】稀硫酸 ![]() 取少量滤液1于试管中,加入铁氰化钾溶液,若无蓝色沉淀生成,证明
取少量滤液1于试管中,加入铁氰化钾溶液,若无蓝色沉淀生成,证明![]() 被氧化完全
被氧化完全  过大,在调节pH环节会多消耗氨水 b
过大,在调节pH环节会多消耗氨水 b ![]()
![]()
【解析】
![]() 、
、![]() 混合溶液与锰泥中的二氧化锰发生氧化还原反应,将亚铁氧化为三价铁,然后过滤滤去硫酸铅和不溶的杂质,向滤液中加氨水来调节溶液的PH值以除去铁离子,并用硫化钠来沉淀铜离子,然后过滤滤去生成的沉淀,最后向滤液中加入过量的碳酸氢铵生成碳酸锰。
混合溶液与锰泥中的二氧化锰发生氧化还原反应,将亚铁氧化为三价铁,然后过滤滤去硫酸铅和不溶的杂质,向滤液中加氨水来调节溶液的PH值以除去铁离子,并用硫化钠来沉淀铜离子,然后过滤滤去生成的沉淀,最后向滤液中加入过量的碳酸氢铵生成碳酸锰。
![]() 高锰酸钾溶液具有强氧化性,盐酸易被氧化生成氯气,一般用稀硫酸酸化;
高锰酸钾溶液具有强氧化性,盐酸易被氧化生成氯气,一般用稀硫酸酸化;
![]() 除去滤液1中的
除去滤液1中的![]() 是硫离子和铜离子生成难溶于水的CuS;
是硫离子和铜离子生成难溶于水的CuS;
![]() 检验
检验![]() 的存在可以加入铁氰化钾溶液,观察是否生成蓝色沉淀;
的存在可以加入铁氰化钾溶液,观察是否生成蓝色沉淀;
![]() 生产时
生产时![]() 、
、![]() 混合溶液中
混合溶液中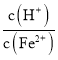 控制在
控制在![]() 之间,不宜过大,如果比值越大说明硫酸的含量越高,后面用氨水调节PH时消耗的氨水的量多,造成原料的浪费;
之间,不宜过大,如果比值越大说明硫酸的含量越高,后面用氨水调节PH时消耗的氨水的量多,造成原料的浪费;
![]() 若
若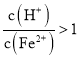 ,调节
,调节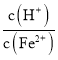 到
到![]() 的方法是减小氢离子而增加亚铁离子的浓度,所以最好加入铁与氢离子发生反应,生成氢气从而消耗氢离子,同时生成亚铁离子;
的方法是减小氢离子而增加亚铁离子的浓度,所以最好加入铁与氢离子发生反应,生成氢气从而消耗氢离子,同时生成亚铁离子;
![]() 滤液2中的锰离子与
滤液2中的锰离子与![]() 反应生成碳酸锰和二氧化碳与水;
反应生成碳酸锰和二氧化碳与水;
![]() 锰泥中含
锰泥中含![]() 的
的![]() ,锰回收率可达
,锰回收率可达![]() ,根据关系式
,根据关系式![]() ,进行计算。
,进行计算。
![]() 高锰酸钾溶液具有强氧化性,盐酸易被氧化生成氯气,一般用稀硫酸酸化,
高锰酸钾溶液具有强氧化性,盐酸易被氧化生成氯气,一般用稀硫酸酸化,
故答案为:稀硫酸;
![]() 除去滤液1中的
除去滤液1中的![]() 是硫离子和铜离子生成难溶于水的CuS,反应的离子方程式为:
是硫离子和铜离子生成难溶于水的CuS,反应的离子方程式为:![]() ,
,
故答案为:![]() ;
;
![]() 检验
检验![]() 的存在加入铁氰化钾溶液,观察溶液中是否产生蓝色沉淀,
的存在加入铁氰化钾溶液,观察溶液中是否产生蓝色沉淀,
故答案为:取少量滤液1于试管中,加入铁氰化钾溶液,若无蓝色沉淀生成,证明![]() 被氧化完全;
被氧化完全;
![]() 生产时
生产时![]() 、
、![]() 混合溶液中
混合溶液中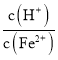 控制在
控制在![]() 之间,不宜过大,如果比值越大说明硫酸的含量越高,后面用氨水调节PH时消耗的氨水的量多,造成原料的浪费,
之间,不宜过大,如果比值越大说明硫酸的含量越高,后面用氨水调节PH时消耗的氨水的量多,造成原料的浪费,
故答案为: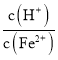 过大,在调节pH环节会多消耗氨水;
过大,在调节pH环节会多消耗氨水;
③若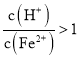 ,调节
,调节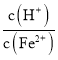 到
到![]() 的方法是减小氢离子而增加亚铁离子的浓度,所以最好加入铁与氢离子发生反应,生成氢气从而消耗氢离子,同时生成亚铁离子,所以最理想的试剂是铁粉,
的方法是减小氢离子而增加亚铁离子的浓度,所以最好加入铁与氢离子发生反应,生成氢气从而消耗氢离子,同时生成亚铁离子,所以最理想的试剂是铁粉,
故答案为:b;
![]() 滤液2中的锰离子与
滤液2中的锰离子与![]() 反应生成碳酸锰和二氧化碳与水,所以离子方程式为:
反应生成碳酸锰和二氧化碳与水,所以离子方程式为:![]() ,
,
故答案为:![]() ;
;
![]() 锰泥中含
锰泥中含![]() 的
的![]() ,锰回收率可达
,锰回收率可达![]() ,根据关系式
,根据关系式 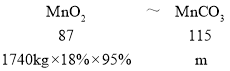 ,
,![]() ,解之得
,解之得![]() ,
,
故答案为:![]() .
.


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案科目:高中化学 来源: 题型:
【题目】已知某弱酸的酸式盐NaH2XO4和Na2HXO4,其中NaH2XO4溶液呈弱酸性,Na2HXO4呈弱碱性,在10℃时,浓度为0.1molL-1的NaH2XO4和Na2HXO4溶液中均存在的关系是( )
A.c(H+)c(OH-)>1×10-14
B.c(Na+)+c(H+)=c(H2XO4-)+c(OH-)+2c(HXO42-)+3c(XO43-)
C.c(H+)+2c(H3XO4)+c(H2XO4-)=c(XO43-)+c(OH-)
D.c(Na+)=c(H3XO4)+c(HXO42-)+c(XO43-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对室温下氢离子浓度、体积均相同的HCl溶液和CH3COOH溶液分别采取以下措施,
有关叙述正确的是( )
A.加适量的CH3COONa晶体,两溶液的氢离子浓度减小
B.使温度升高20 ℃,两溶液的氢离子浓度不变
C.加水稀释2倍,两溶液的氢离子浓度增大
D.加足量的Zn充分反应后,两溶液中产生的氢气一样多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水资源的开发和利用是当前科学研究的一项重要任务。下图是实验室模拟镁开发的流程图:
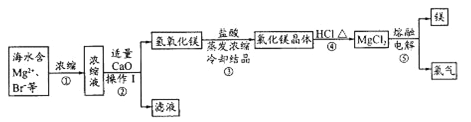
根据上述流程图,回答下列问题:
(1)操作I的名称是________。
(2)步骤中②反应的化学方程式为________。
(3)步骤④中加热时通入HCl气流的作用是__________。
(4)步骤⑤的离子反应方程式为___________。
(5)有人提出步骤⑤的副产物可在流程中再利用以提高海水的综合利用率。若A为上述流程中的某组分,则A、B分别为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业采用氯化铵焙烧菱锰矿制备高纯碳酸锰的流程如图所示:
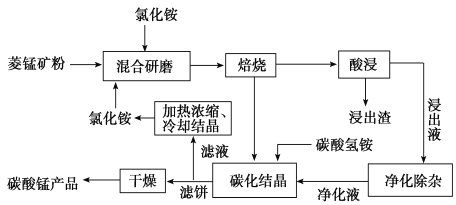
已知:
①菱锰矿的主要成分是![]() ,其中含Fe、Ca、Mg、Al等元素。
,其中含Fe、Ca、Mg、Al等元素。
②![]() 、
、![]() 沉淀完全的pH分别为
沉淀完全的pH分别为![]() 、
、![]() ,
,![]() 、
、![]() 开始沉淀的pH分别为
开始沉淀的pH分别为![]() 、
、![]() 。
。
![]() 焙烧过程中主要反应为
焙烧过程中主要反应为![]() 。
。
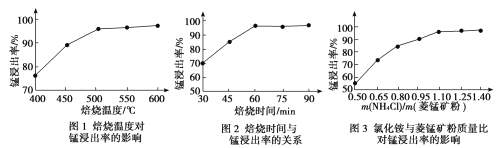
![]() 结合图1、2、3,分析焙烧过程中最佳的焙烧温度、焙烧时间、
结合图1、2、3,分析焙烧过程中最佳的焙烧温度、焙烧时间、 分别为______、______、______。
分别为______、______、______。
![]() 对浸出液净化除杂时,需先加入
对浸出液净化除杂时,需先加入![]() 将
将![]() 转化为
转化为![]() ,再调节溶液pH的范围为______,将
,再调节溶液pH的范围为______,将![]() 和
和![]() 变为沉淀而除去,然后加入
变为沉淀而除去,然后加入![]() 将
将![]() 、
、![]() 变为氟化物沉淀除去。
变为氟化物沉淀除去。
![]() “碳化结晶”步骤中,加入碳酸氢铵时反应的离子方程式为______。
“碳化结晶”步骤中,加入碳酸氢铵时反应的离子方程式为______。
![]() 上述流程中可循环使用的物质是______。
上述流程中可循环使用的物质是______。
![]() 现用滴定法测定浸出液中
现用滴定法测定浸出液中![]() 的含量。实验步骤:称取
的含量。实验步骤:称取![]() g试样,向其中加入稍过量的磷酸和硝酸,加热使反应
g试样,向其中加入稍过量的磷酸和硝酸,加热使反应![]() 充分进行并除去多余的硝酸;加入稍过量的硫酸铵,发生反应
充分进行并除去多余的硝酸;加入稍过量的硫酸铵,发生反应![]() 以除去
以除去![]() ;加入稀硫酸酸化,用
;加入稀硫酸酸化,用![]()
![]() 10.00mL硫酸亚铁铵标准溶液进行滴定,发生的反应为
10.00mL硫酸亚铁铵标准溶液进行滴定,发生的反应为![]() ;用
;用![]()
![]() 10.00mL酸性
10.00mL酸性![]() 溶液恰好除去过量的
溶液恰好除去过量的![]() 。
。
![]() 酸性
酸性![]() 溶液与
溶液与![]() 反应
反应![]() 还原产物是
还原产物是![]() 的离子方程式为______。
的离子方程式为______。
![]() 试样中锰的质量分数为______。
试样中锰的质量分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,还有少量的Fe2O3,SiO2等杂质)提取氧化铝作冶炼铝的原料,提取的操作过程如下:
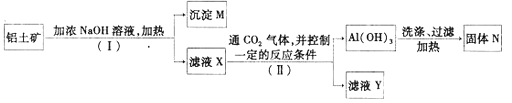
(1)Ⅰ和Ⅱ步骤中分离溶液和沉淀的操作是:_____________。
(2)沉淀M中除含有泥沙外,一定还含有_________(填化学式),生成固体N反应的化学方程式为_________。
(3)滤液X中,含铝元素的溶质的化学式为___________,它属于__________(填“酸”、“碱”或“盐”)类物质。
(4)实验室里常往AlCl3溶液中加入___________(填“氨水”或“NaOH溶液”)来制取Al(OH)3,该反应的离子方程式为__________________________。
(5)滤液Y中除了含有Na2CO3或NaHCO3外,一定还含有__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应mA(s)+nB(g)![]() eC(g)+fD(气)反应过程中,当其他条件不变时,C的体积分数在不同温度(T)和不同压强(P)的条件下随时间(t)的变化关系如图所示。下列叙述正确的是( )
eC(g)+fD(气)反应过程中,当其他条件不变时,C的体积分数在不同温度(T)和不同压强(P)的条件下随时间(t)的变化关系如图所示。下列叙述正确的是( )
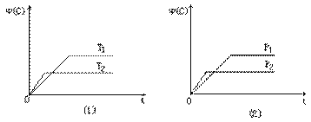
A.达到平衡后,若使用催化剂,C的体积分数将增大
B.当平衡后,若温度升高,化学平衡向逆反应方向移动
C.化学方程式中,n>e+f
D.达到平衡后,增加A的质量有利于化学平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧(O3)能与KI溶液反应,生成氧气等。在反应后的溶液中滴入酚酞变为红色。若滴入淀粉则变为蓝色。为测定环境中空气的臭氧含量,将0℃、1.01×105Pa的空气33.6m3通过KI溶液,使反应完全,在所得溶液中用0.0100mol·L-1的Na2S2O3溶液60.0mL恰好滴定达终点,反应为:2Na2S2O3+I2→Na2S4O6+2NaI
(1)臭氧通入KI溶液中的化学方程式是________,每消耗1molO3,转移___mole-。
(2)计算大气中臭氧的体积分数___。(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A. 向0.1mol/LCH3COOH溶液中加入少量水,溶液中c(H+)/c(CH3COOH)减小
B. 将CH3COONa溶液从20℃升温至30℃,溶液中c(CH3COO-)/c(CH3COOH)·c(OH-)增大
C. 向盐酸中加入氨水至中性,溶液中c(NH4+)/c(Cl-)>1
D. 向AgCl、AgBr的饱和溶液中加入少量硝酸银,溶液中c(Cl-)/c(Br-)不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com