
| |||||||||||
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源:江苏2009高三各地名校化学月考试题汇编(钠和碱金属) 题型:058
某中学化学教材上有如下介绍:“在氢氧化钠浓溶液中加入氧化钙,加热,制得白色固体就是碱石灰,它是水和二氧化碳的吸收剂”.有两个实验小组决定通过实验来探究碱石灰的组成.
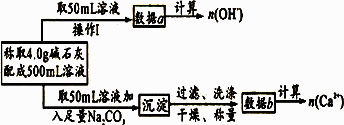
(1)第一小组设计的实验方案如下:
下列关于溶液中n(OH-)、n(Ca2+)、n(Na+)之间的关系式正确的是________
A.n(Na+)+2n(Ca2+)=n(OH-)
B.2n(Na+)+2n(Ca2+)=n(OH-)
C.n(Na+)+n(Ca2+)=2n(OH-)
现有4.0 g碱石灰,设其中n(Na+)=xmol,n(Ca2+)=ymol,请填写下列空格:
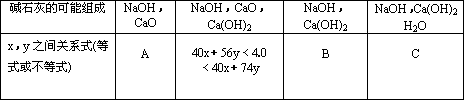
把表中A、C的关系式填在下面空格上:
A:________C:________.
(2)第二小组查得如下资料:氢氧化钙在250℃时不分解,高于250℃时才分解;氢氧化钠在580℃时不分解.他们设计了如下方案并得出相应相关数据:取市售碱石灰4.0 g,在250℃时加热至恒重,测得固体质量减少了0.6 g,剩余固体在580℃时继续加热至恒重,测得固体质量又减少了0.7 g.请通过计算确定该碱石灰各成分的质量分数?(要计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
中学教材高中化学第一册有如图3所示的铜与浓硫酸反应实验装置,该实验过程中会有二氧化硫气体放出,污染室内空气,严重地损害师生健康.为此某课外小组对此实验进行如图4所示的改进,改进的实验操作简单现象明显,并且几乎无二氧化硫气体泄漏。实验步骤如下:
①首先按装置图安装仪器,安装仪器时,在支管胶塞的铁丝构上挂一片品红试纸。
②向试管中加入约10毫升的浓硫酸,加热(在加热浓硫酸时,将铜片向上提起,铜片先不要伸入浓硫酸中),当加热至沸腾时,把铜片放下,使其完全浸入浓硫酸中,反应即刻发生。等不需要反应时停止加热并将铜片提起,离开浓硫酸,反应就停止了。
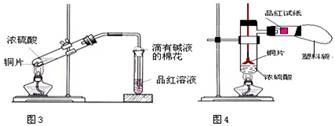
回答下列问题:
(1)如图4所示,铜片与沸腾的浓硫酸接触后可看到的现象有: ;
(2)塑料袋作用是: ;
(3)为了防止反应结束后留在试管中的气体和塑料袋中的气体污染环境,可 进 行 的 操 作是:
相关的离子方程式是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
中学教材高中化学第一册有如下图1所示的铜与浓硫酸反应实验装置,该实验过程中会有二氧化硫气体放出,污染室内空气,严重地损害师生健康.为此某课外小组对此实验进行如图2所示的改进,改进的实验操作简单现象明显,并且几乎无二氧化硫气体泄漏。实验步骤如下:
![]()
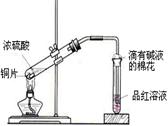

![]() 图1 图2
图1 图2
![]() ①首先按装置图安装仪器,安装仪器时,在支管胶塞的铁丝构上挂一片品红试纸。
①首先按装置图安装仪器,安装仪器时,在支管胶塞的铁丝构上挂一片品红试纸。
![]() ②向试管中加入约10毫升的浓硫酸,加热(在加热浓硫酸时,将铜片向上提起,铜片先不要伸入浓硫酸中),当加热至沸腾时,把铜片放下,使其完全浸入浓硫酸中,反应即刻发生。等不需要反应时停止加热并将铜片提起,离开浓硫酸,反应就停止了。
②向试管中加入约10毫升的浓硫酸,加热(在加热浓硫酸时,将铜片向上提起,铜片先不要伸入浓硫酸中),当加热至沸腾时,把铜片放下,使其完全浸入浓硫酸中,反应即刻发生。等不需要反应时停止加热并将铜片提起,离开浓硫酸,反应就停止了。
![]() 回答下列问题:
回答下列问题:
![]() (1)如图2所示,铜片与沸腾的浓硫酸接触后可看到的现象有: ;
(1)如图2所示,铜片与沸腾的浓硫酸接触后可看到的现象有: ;
![]() (2)塑料袋作用是: ;
(2)塑料袋作用是: ;
![]() (3)为了防止反应结束后留在试管中的气体和塑料袋中的气体污染环境,可进行的操作是: ;相关的离子方程式是: 。
(3)为了防止反应结束后留在试管中的气体和塑料袋中的气体污染环境,可进行的操作是: ;相关的离子方程式是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)中学化学教材上有如下介绍:在氢氧化钠浓溶液中加入氧化钙,加热,制成的白色固体就是碱石灰。试根据题目的要求,回答下列问题:
(1)这种碱石灰中,除NaOH外还可能含有的物质是(可填满、可不填满也可补充)
情况1 | 情况2 | 情况3 | 情况4 | 情况5 |
|
|
|
|
|
(2)为探究这种碱石灰的组成,某校研究性学习小组(甲)设计的思路是:称取4.0g碱石灰配成500mL溶液,用pH计测溶液的pH,然后再通过 (填实验方法)测 (填物理量名称)即可推算出其组成的成分。
(3)研究性学习小组(乙)查得如下资料:氢氧化钙在250℃时不分解,氢氧化钠在580℃时不分解。他们设计了如下方案并得出相关数据:取该法制得的碱石灰4.0g,在250℃时加热至恒重,测得固体质量减少了0.6g,剩余固体在580℃时继续加热至恒重,固体质量又减少了0.7g 。请通过计算确定该碱石灰各成分的质量分数。
(4)为使该法制得的碱石灰所起的效果更好,除控制好NaOH与CaO的配比外,还需控制的实验条件是什么?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com