
 高炉炼铁中发生的基本反应之一如下:FeO(s)+CO(g)?Fe(s)+CO2(g)(正反应是吸热反应),其平衡常数可表示为:K=
高炉炼铁中发生的基本反应之一如下:FeO(s)+CO(g)?Fe(s)+CO2(g)(正反应是吸热反应),其平衡常数可表示为:K=| c(CO2) |
| c(CO) |
| △c |
| △t |
| c(CO2) |
| c(CO) |
| 0.25mol/L |
| 0.1mol/L |
| 2.25mol/L |
| 10min |


科目:高中化学 来源: 题型:
 4种相邻主族短周期元素的相对位置如表,元素x的原子核外电子数是m的2倍,y的氧化物具有两性,回答下列问题:
4种相邻主族短周期元素的相对位置如表,元素x的原子核外电子数是m的2倍,y的氧化物具有两性,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
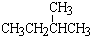 ; ⑧CH3CH2CH2CH3与CH3CH(CH3)2
; ⑧CH3CH2CH2CH3与CH3CH(CH3)2查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定次数 | 待测液体积 (mL) |
标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
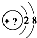 某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断.
某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 | B、3 | C、4 | D、5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com