
| A、乙炔 |
| B、1,3-丁二烯 |
| C、1-丙炔 |
| D、1,3-环己二烯 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:

| O | 2- 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
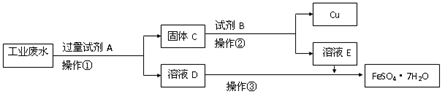 某工厂的酸性废水中含有大量的Fe3+、Cu2+、SO42-和少量Na+.为了减少污染并变废为宝,工程师们设计了如下流程,回收铜和绿矾.
某工厂的酸性废水中含有大量的Fe3+、Cu2+、SO42-和少量Na+.为了减少污染并变废为宝,工程师们设计了如下流程,回收铜和绿矾.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、③④⑤ | B、①④⑥⑦ |
| C、②③④⑤ | D、②③④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲烷分子中任意三个H原子都构成正三角形 |
| B、二氯甲烷无同分异构体 |
| C、甲烷分子中四个C-H键的键长、键能、键角都相等 |
| D、丙烷无同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②③④ | B、①②③ |
| C、①③ | D、①② |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
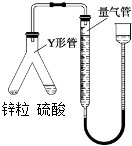
| A、实验时,将硫酸溶液倾斜倒入锌粒中 |
| B、实验时,量气管压入漏斗的水过多而溢出,不影响实验 |
| C、实验时,待体系温度降低到0℃时方可进行读数 |
| D、实验时,用CCl4代替水,测得氢气的体积更准确 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com