
| A. | NaHSO3溶液中水的电离程度小于Na2SO3 溶液,也小于Na2SO4 溶液 | |
| B. | [HSO3-]>[SO32-]>[H2SO3 ] | |
| C. | 该溶液中由水电离出的[H+]为1×10-4mol/L | |
| D. | 加入少量NaOH使溶液的pH升高会使水的电离受到抑制 |
分析 A.多元弱酸根离子的水解,第一步水解程度远远大于第二步水解程度;硫酸钠是强酸强碱盐,不水解;
B.某NaHSO3溶液的pH=4,说明HSO3-的电离程度大于水解程度,但程度都较小;
C.该溶液中由水电离出的[H+]=$\frac{{K}_{w}}{c({H}^{+})}$;
D.加入少量NaOH溶液,二者反应生成Na2SO3,亚硫酸钠水解程度大于亚硫酸氢钠,导致溶液pH升高;弱酸根离子水解程度越大则水的电离程度越大.
解答 解:A.多元弱酸根离子的水解,第一步水解程度远远大于第二步水解程度;硫酸钠是强酸强碱盐,不水解,所以NaHSO3溶液中水的电离程度小于Na2SO3 溶液,Na2SO4 不水解,故A错误;
B.某NaHSO3溶液的pH=4,说明HSO3-的电离程度大于水解程度,但程度都较小,所以离子浓度大小顺序是[HSO3-]>[SO32-]>[H2SO3 ],故B正确;
C.该溶液中由水电离出的[H+]=$\frac{{K}_{w}}{c({H}^{+})}$=$\frac{1{0}^{-14}}{1{0}^{-4}}$mol/L=10-10 mol/L,故C错误;
D.加入少量NaOH溶液,二者反应生成Na2SO3,亚硫酸钠水解程度大于亚硫酸氢钠,导致溶液pH升高;弱酸根离子水解程度越大则水的电离程度越大,所以会促进水的电离,故D错误;
故选B.
点评 本题考查盐类水解,为高频考点,涉及离子浓度大小比较、水的电离等知识点,明确“某NaHSO3溶液的pH=4”与HSO3-的电离程度、水解程度相对大小关系是解本题关键,易错选项是C,注意水电离出氢离子、氢氧根离子计算方法,题目难度不大.


科目:高中化学 来源: 题型:选择题
 如表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
如表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )| A. | X、Y、Z的阴离子电子层结构均与R原子的相同 | |
| B. | 常压下,Y单质的沸点比Z单质的沸点高 | |
| C. | W的氢化物的稳定性比X的氢化物的稳定性强 | |
| D. | 最高价氧化物的水化物酸性W比Y强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14g 乙烯和丁烯的混合物中含有3NA对共用电子对 | |
| B. | 1mol苯中含有3NA个碳碳双键 | |
| C. | 乙烷与Cl2在光照下反应,每有NA个氢原子被氯替代,需消耗标准状况下Cl2 11.2L | |
| D. | 标准状况下,22.4L己烷中的碳原子数为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
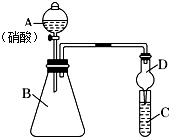 学习了元素周期律的有关知识后,某同学根据元素非金属性与对应最高价含氧酸之间的关系,选择由短周期元素组成的化合物设计了如图1装置来一次性完成同主族和同周期元素非金属性强弱比较的实验研究.
学习了元素周期律的有关知识后,某同学根据元素非金属性与对应最高价含氧酸之间的关系,选择由短周期元素组成的化合物设计了如图1装置来一次性完成同主族和同周期元素非金属性强弱比较的实验研究.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
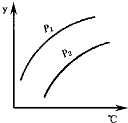 如图表示不同温度和压强下,对可逆反应2L(气)?2M(气)+N(气)△H>0平衡状态的影响(p1<p2),图中y轴表示的意义是( )
如图表示不同温度和压强下,对可逆反应2L(气)?2M(气)+N(气)△H>0平衡状态的影响(p1<p2),图中y轴表示的意义是( )| A. | 一定条件下L的转化率 | B. | 气体混合物的平均摩尔质量 | ||
| C. | 气体混合物中L的体积分数 | D. | 气体L的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 铝热反应实验如下:用两张圆形滤纸分别折叠成漏斗状,套在一起(先将置于内层的漏斗底部剪一个小孔,用水润湿),架在铁架台的铁圈上,下面放置盛沙的蒸发皿.将适量的炒干的氧化铁粉末和铝粉混合均匀,放在纸漏斗中,上面加少量氯酸钾并在混合物中间插一根镁条,用小木条点燃镁条,引燃氧化铁和铝粉的混合物,反应剧烈进行,发出耀眼的强光,生成铁和氧化铝.
铝热反应实验如下:用两张圆形滤纸分别折叠成漏斗状,套在一起(先将置于内层的漏斗底部剪一个小孔,用水润湿),架在铁架台的铁圈上,下面放置盛沙的蒸发皿.将适量的炒干的氧化铁粉末和铝粉混合均匀,放在纸漏斗中,上面加少量氯酸钾并在混合物中间插一根镁条,用小木条点燃镁条,引燃氧化铁和铝粉的混合物,反应剧烈进行,发出耀眼的强光,生成铁和氧化铝.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
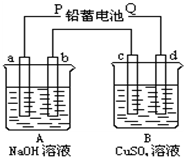 用如图装置实验,A、B两烧杯分别盛放200g10%NaOH和足量CuSO4溶液.通电一段时间后,c极上有Cu析出,又测得A杯中溶液的质量减少4.5g(不考虑水的蒸发).
用如图装置实验,A、B两烧杯分别盛放200g10%NaOH和足量CuSO4溶液.通电一段时间后,c极上有Cu析出,又测得A杯中溶液的质量减少4.5g(不考虑水的蒸发).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com