
【题目】将28.8g铜与150mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为11.2L。请回答:
(1)NO的体积为___L,NO2的体积为___L;
(2)待产生的气体全部释放,向溶液中加入200mL5mol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为___mol·L-1。
【答案】4.48 6.72 10
【解析】
发生Cu+4HNO3(浓)=Cu(NO3)2+NO2↑+2H2O、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,n(Cu)=![]() =0.45mol,混合气体物质的量为
=0.45mol,混合气体物质的量为![]() =0.5mol;
=0.5mol;
(1)设NO的为xmol,NO2的为ymol,因为铜与硝酸的反应是一个氧化还原反应,根据题意及电子得失守恒列式计算;
(2)当Cu2+全部转化成沉淀时,溶液中的溶质为NaNO3,因此,根据氮元素守恒,HNO3的物质的量为n(Na+)+n(NO)+n(NO2)。
(1)NO和NO2混合气体在标准状况下的体积为11.2L,则物质的量为0.5mol;设混合气体中NO的物质的量为x,NO2的物质的量为y,根据元素守恒有①:x+y=0.5mol;28.8g铜的物质的量为![]() =0.45mol,反应过程中Cu为唯一还原剂,根据电子守恒有②:3x+y=0.45mol×2,联立式①②可解得x=0.2mol,y=0.3mol,即混合气体中含0.2molNO和0.3molNO2,体积分别为4.48L和6.72L;
=0.45mol,反应过程中Cu为唯一还原剂,根据电子守恒有②:3x+y=0.45mol×2,联立式①②可解得x=0.2mol,y=0.3mol,即混合气体中含0.2molNO和0.3molNO2,体积分别为4.48L和6.72L;
(2)当溶液中的Cu2+全部转化成沉淀时,溶液中的溶质为NaNO3,所以n(NaNO3)=n(Na+)= n(NaOH)=5mol·L-1×0.2L=1mol,根据元素守恒可知原溶液中n(HNO3)= n(NaNO3)+ n(NO)+n(NO2)=1mol+0.2mol+0.3mol=1.5mol,所以浓度为![]() =10mol·L-1。
=10mol·L-1。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】根据下图所示实验回答下列问题:

(1)装置A中试管内发生反应的化学方程式是_________________________________。
(2)根据装置B中的现象可以证明SO2具有__________性,反应一段时间后,将装置B中试管加热,可以观察到_______________________。
(3)装置C中试管口的棉花团上发生反应的离子方程式为________________________。
(4)如果将装置B换成装置D,并从直立导管中向氯化钡溶液中通入另一种气体,产生白色沉淀,则这种气体可能是_________________(填一种即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充放电池。下图为RFC工作原理示意图,有关说法正确的是( )
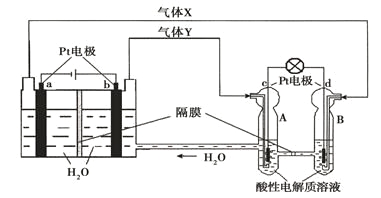
A.当有0.1mol电子转移时,a极产生1.12L O2(标准状况下)
B.b极上发生的电极反应是:4H2O + 4e-= 2H2↑+ 4OH-
C.d极上发生的电极反应是:O2+ 4H++ 4e-= 2H2O
D.c极上进行还原反应,B中的H+可以通过隔膜进入A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常温条件下浓度均为0.1 molL-1的甲、乙、丙、丁四种溶液,甲为NaOH溶液,乙为HCl溶液,丙为CH3COOH溶液,丁为氨水,已知Ka(CH3COOH)=Kb(NH3H2O)试回答下列问题:
(1)甲、丁种溶液中由水电离出的c(OH)的大小关系为甲___丁(填“大于”“小于”或“等于”)。
(2)将一定体积的甲与乙混合,所得溶液pH=12,则二者的体积比为v甲∶v乙=___。
(3)某同学用甲滴定丙溶液、乙滴定丁溶液,得到如图所示两条滴定曲线,请完成有关问题:
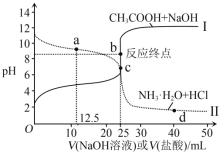
①乙溶液滴定丁溶液最适合的指示剂是___;甲溶液滴定丙溶液,选用酚酞为指示剂,则达到滴定终点的标志是___。
②计算滴定至b点时,c(CH3COOH)+c(CH3COO-)=___molL-1
③向氨水中滴加盐酸至a点,溶液中离子浓度从大到小的顺序为___,若加盐酸vmL时,溶液恰好呈中性,用含v的代数式表示出Kb=___(不考虑溶液混合体积变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列各题
(1)工业上制取粗硅的化学反应方程式_________________
(2)实验室用氯气制取少量“84”消毒液方程式________________
(3)铜和浓硫酸化学反应方程式_________________
(4)二氧化硅与氢氧化钠溶液反应的离子方程式_________________
(5)用电子式表示氯化镁的形成过程__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为元素周期表中原子序数依次增大的短周期主族元素,X、Y、Z分别为B、C、E对应的单质,甲、乙 、丙、丁为其中部分元素组成的化合物,其中C、D同主族,甲是一种能使湿润的红色石蕊试纸变蓝的气体,甲可用于检验Z气体是否泄漏。上述物质间的转化关系如图所示:

(1)B、C、D、E四种元素形成的简单离子中,离子半径由小到大的顺序是___(用化学用语表示)。
(2)下列事实能说明D元素的非金属性小于E的是___
a.对应氢化物的还原性:D>E
b.D和E两元素的简单氢化物受热分解,后者的分解温度高
c.单质的沸点:D>E
(3)已知元素Ts位于第七周期,与E同族,写出其中子数为176的核素符号___,预测Ts及其化合物最不可能具有的性质是___。
a.单质易溶于某些有机溶剂 b.单质是有色固体
c.氢化物很稳定 d.简单阴离子可与Ag+形成难溶物
(4)A、B两种元素可组成一种离子化合物BA5,该化合物的电子式为___。
(5)A、B、D三种元素组成离子化合物W,已知:
①1molW能与足量氢氧化钠溶液共热,生成22.4L气体(标准状况);
②W能与盐酸反应产生一种臭鸡蛋气味的气体。则W是___,写出①的离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2 2NO + O2 (NO2为红棕色气体,其余气体无色)在恒温恒容密闭容器中进行,达到限度的标志是
① 单位时间内生成n mol O2的同时生成2n mol NO2
② v正(NO)=v逆(O2)
③ 混合气体的平均相对分子质量不再改变的状态
④ 混合气体的颜色不再改变的状态
⑤ 混合气体的密度不再改变的状态
⑥ 混合气体的压强不再改变的状态
⑦ 用NO2与NO、O2表示的反应速率之比为2:2:1的状态
A.①③④⑥B.②③⑤⑦C.①③④⑤D.①②⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香族化合物Q的相对分子质量为148,Q既能使溴的四氯化碳溶液褪色,又能与小苏打反应放出气体。下列有关Q的叙述错误的是
A. 分子式为C9H8O2 B. 发生酯化反应
C. 结构简式有5种 D. 分子中所有原子不能处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2NaHCO3![]() Na2CO3 + H2O+CO2 ,现把14.8g Na2CO310H2O和NaHCO3组成的固体混合物溶于水配成100mL溶液,其中c(Na+)=1.2molL﹣1,若把等质量的固体混合物加热至恒重,残留固体质量是( )
Na2CO3 + H2O+CO2 ,现把14.8g Na2CO310H2O和NaHCO3组成的固体混合物溶于水配成100mL溶液,其中c(Na+)=1.2molL﹣1,若把等质量的固体混合物加热至恒重,残留固体质量是( )
A. 6.36gB. 3.18gC. 4.22gD. 5.28g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com