
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
科目:高中化学 来源: 题型:推断题
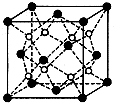 有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E的原子各内层均排满,且最外层有成单电子;D与E同周期,价电子数为2.则:
有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E的原子各内层均排满,且最外层有成单电子;D与E同周期,价电子数为2.则:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
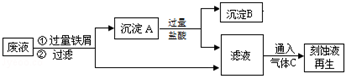
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
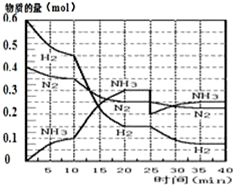 氨的合成原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.4KJ•mol-1.现在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图.
氨的合成原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.4KJ•mol-1.现在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图.| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 物质 | SiCl4 | AlCl3 | FeCl3[来 | FeCl2 |
| 沸点/℃ | 57.6 | 180(升华) | 300(升华) | 1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该物质分子式为C7H10O5 | |
| B. | 该物质与乙酸互为同系物 | |
| C. | 该物质能与乙醇发生酯化反应 | |
| D. | 1 mol该物质与Na反应时,最多消耗Na 4 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示是锌、铜和稀硫酸形成的原电池,某同学做完实验后,在读书卡片上记录如下:
如图所示是锌、铜和稀硫酸形成的原电池,某同学做完实验后,在读书卡片上记录如下:| A. | ③④⑤ | B. | ①②③ | C. | ①⑤⑥ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①④⑤ | C. | ②④⑤ | D. | ①⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com