
【题目】鉴别油脂和石蜡油的试剂最好是
A. 硫酸 B. 食盐 C. NaOH的酚酞溶液 D. Na2CO3溶液
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:
【题目】硫代硫酸钠晶体(Na2S2O3·5H2O)俗名海波,是无色单斜晶体。 它易溶于水,不溶于乙醇,具有较强的还原性, 可应用于照相等工业中。回答下列问题:
(1)Na2S2O3·5H2O 属于________(填“纯净物”或“混合物”)。
(2)酸性条件下, S2O32-自身发生氧化还原反应生成 SO2。试写出 Na2S2O3 与盐酸反应的离子方程式:_________________________________________。
(3)亚硫酸钠法制备Na2S2O3·5H2O简易流程如下:

①Na2S2O3·5H2O制备原理为_________________________________________(用化学方程式表示)。
②Na2S2O3·5H2O粗品中可能含有Na2S2O3、 Na2SO4杂质,其检验步骤为:取适量产品配成稀溶液,滴加足量氯化钡溶液,有白色沉淀生成;过滤,先用蒸馏水洗涤沉淀,然后向沉淀中加入足量______________ (填试剂名称),若___________________________(填现象),则证明产品中含有Na2SO3和 Na2SO4(已知: Na2S2O3 稀溶液与BaCl2溶液无沉淀生成)。
③粗品中Na2S2O3·5H2O的质量分数的测定称取 6 g 粗品配制 250 mL 的溶液待用。另取 25.00 mL 0.0100 mol· L-1 K2Cr2O7 溶液于锥形瓶中,然后加入过量酸化的 KI 溶液并酸化和几滴淀粉溶液,立即用配制的 Na2S2O3溶液滴定至终点,消耗 Na2S2O3 溶液 25.00 mL。 滴定终点的现象是________。粗品中Na2S2O3·5H2O的质量分数为__________。已知 Cr2O72-+6I-+ 14 H+ =2Cr3++ 3I2+7H2O、 I2+2S2O32- =2I-+S4O62-。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是化学常见的三种物质,它们之间的相互转化关系如下(反应条件及部分产物已略去):
![]()
(1)若A是一种黄色固体单质,则反应②③的化学方程式分别为_________________; _______________。D的浓溶液与Cu反应的化学方程式______________________________________________。
(2)若A是一种金属单质,C是淡黄色固体,则反应③的化学方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是( )
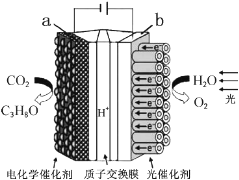
A. 该装置将化学能转化为光能和电能
B. 该装置工作时,H+从b极区向a极区迁移
C. 每生成1molO2,有44g CO2被还原
D. a电极的反应为:3CO2+18H+-18e-=C3H8O+5H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有HA、HB和H2C三种酸。室温下用0.1mol·L-1NaOH溶液分别滴定20.00 mL浓度均为0.1mol·L-1的HA、HB两种酸的溶液,滴定过程中溶液的pH随滴入的NaOH 溶液体积的变化如图所示。
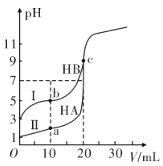
(1)a点时的溶液中由水电离出的c(H+)=________mol·L-1,Ka(HB)=________。
(2)与曲线I 上的c点对应的溶液中各离子浓度由大到小的顺序为________;b点对应的溶液中c(HB)____c(B-)(填“>”“<”或“=”)。
(3)已知常温下向0.1mol·L-1的NaHC 溶液中滴入几滴石蕊试液后溶液变成红色。
①若测得此溶液的pH=1,则NaHC的电离方程式为_______________。
②若在此溶液中能检测到H2C 分子,则此溶液中c(C2-)________c(H2C)(填“>”“<”或“=”)。
③若H2C的一级电离为H2C=H++ HC-,常温下0.1mol·L-1H2C溶液中的c(H+ )=0.11mol·L-1,则0.1mol·L-1NaHC溶液中的c(H+)________0.01mol·L-1(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以镍矿粉(主要成分为NiS,杂质FeS、CuS和SiO2等)为原料可制备NiCO3
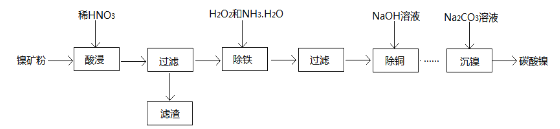
已知Ni和Fe为变价金属,常见化合价为+2价、+3价。
(1)在酸浸过程中,CuS与稀HNO3反应生成淡黄色固体,其离子方程式为___________________,滤渣的主要成分为________________________;
(2)在除FeS时,需加入过量的H2O2氧化,若用过强的氧化剂,其可能的后果是_______________;反应完全后,除去多余H2O2的简便方法是______________________;
(3)在“沉镍”工艺中,若将含Ni2+溶液缓慢加入至盛有Na2CO3溶液的反应容器中,可能会形成杂质,其原因是_______________________(用离子方程式表示)。检验碳酸镍沉淀完全的方法是__________________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com