
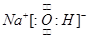 ;离子键、极性共价键
;离子键、极性共价键 SH-+OH-
SH-+OH-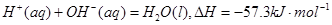
 SH-+OH-,(3)0.05mol的NaOH和0.025mol的H2SO4反应放出热量2865焦,生成0.05摩尔水,根据物质的量与焓变成正比,可以计算出生成1摩尔水放出热量57.3KJ,(4)氨气在负极失电子发生氧化反应,根据电荷守恒和原子守恒可以写出电极反应式2NH3-6e-+ 6OH- =N2+6H2O
SH-+OH-,(3)0.05mol的NaOH和0.025mol的H2SO4反应放出热量2865焦,生成0.05摩尔水,根据物质的量与焓变成正比,可以计算出生成1摩尔水放出热量57.3KJ,(4)氨气在负极失电子发生氧化反应,根据电荷守恒和原子守恒可以写出电极反应式2NH3-6e-+ 6OH- =N2+6H2O 

 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源:不详 题型:填空题
| 元素 | 相关信息 |
| X | X原子基态时最外层电子数是其内层电子总数的2倍 |
| Y | Y的基态原子最外层电子排布式为nsnnpn+2 |
| Z | Z元素的最高正价与负价代数和为6 |
| W | W基态原子未成对电子数是前30号元素中最多的 |
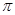 键数目为 。
键数目为 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2EC3(g) △H<0,回答下列问题:
2EC3(g) △H<0,回答下列问题:查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 元素代号 | X | Y | Z | M | R |
| 原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
| 主要化合价 | +1 | +6 -2 | +5 -3 | -2 | +3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.元素W、X的氯化物中,各原子均满足8电子的稳定结构。 |
| B.元素X与氢形成的原子比为1:1的化合物有很多种 |
| C.元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成 |
| D.元素Z可与元素X形成共价化合物XZ2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.热稳定性:Y的气态氢化物<Z的气态氢化物 |
| B.X的最高价氧化物对应水化物的酸性比Y的强 |
| C.X元素的单质能与所有强酸发生反应放出H2 |
| D.R元素的单质化学性质活泼 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com