
【题目】C、N和Si能形成多种高硬度材料,如![]() 、
、![]() 、SiC
、SiC
(1)![]() 和
和![]() 中硬度较高的是______,理由是______。
中硬度较高的是______,理由是______。
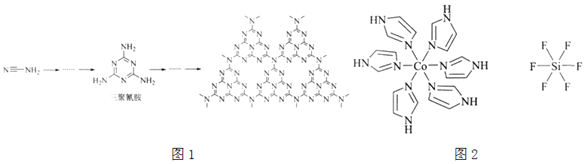
(2)![]() 和N能形成一种类石墨结构材料,其合成过程如图1所示。该类石墨结构材料化合物的化学式为______,其合成过程中有三聚氰胺形成,三聚氰胺中N原子的杂化方式有______。
和N能形成一种类石墨结构材料,其合成过程如图1所示。该类石墨结构材料化合物的化学式为______,其合成过程中有三聚氰胺形成,三聚氰胺中N原子的杂化方式有______。
(3)![]() 和N能形成一种五元环状有机物咪唑
和N能形成一种五元环状有机物咪唑![]() 简写为
简写为![]() ,其结构为
,其结构为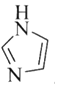
![]() 化合物
化合物![]() 的结构示意图如图2:
的结构示意图如图2:
①阳离子![]() 和
和![]() 之间除了阴阳离子间的静电作用力,还存在氢键作用写出该氢键的表示式:______。
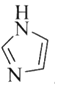
之间除了阴阳离子间的静电作用力,还存在氢键作用写出该氢键的表示式:______。![]() 例如水中氢键的表示式为
例如水中氢键的表示式为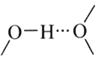
![]()
②多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域![]() 键”,如
键”,如![]() 分子中存在“离域
分子中存在“离域![]() 键”
键”![]() ,则im分子中存在的“离域
,则im分子中存在的“离域![]() 键”是______。
键”是______。
(4)![]() 为立方晶系晶体,该晶胞中原子的坐标参数为
为立方晶系晶体,该晶胞中原子的坐标参数为
C:![]() ;
;![]() ;
;![]() 0,
0,![]() ,
,![]() ;
;![]() ;
;![]()
Si:![]() ;
;![]() ;
;![]() ;
;![]()
则![]() 立方晶胞中含有______个Si原子、______个C原子。
立方晶胞中含有______个Si原子、______个C原子。
【答案】![]() 两者同属原子晶体
两者同属原子晶体![]() 或两者结构相似
或两者结构相似![]() ,C的原子半径小于Si,与
,C的原子半径小于Si,与![]() 相比,
相比,![]() 的键长短、键能大
的键长短、键能大 ![]()
![]() 、
、![]()
![]()
![]() 4 4
4 4
【解析】
![]() 二者均为原子晶体,原子半径越小,共价键键长越短,键能越大,硬度越大;
二者均为原子晶体,原子半径越小,共价键键长越短,键能越大,硬度越大;
![]() 环上N原子形成2个
环上N原子形成2个![]() 键、含有1对孤电子对,氨基中N原子形成3个
键、含有1对孤电子对,氨基中N原子形成3个![]() 键、含有1对孤电子对,杂化轨道数目分别为3、4;
键、含有1对孤电子对,杂化轨道数目分别为3、4;
![]() 原子与N原子连接的H原子之间形成氢键;
原子与N原子连接的H原子之间形成氢键;
![]() 五个原子上的6个p电子参与形成离域
五个原子上的6个p电子参与形成离域![]() 键;
键;
![]() 由C、Si参数可知,C原子处于晶胞的顶点、面心。Si处于晶胞内部,且Si与周围最近的4个C原子形成正四面体结构,将金刚石晶胞内部的碳原子替换为Si即为
由C、Si参数可知,C原子处于晶胞的顶点、面心。Si处于晶胞内部,且Si与周围最近的4个C原子形成正四面体结构,将金刚石晶胞内部的碳原子替换为Si即为![]() 晶胞结构。
晶胞结构。
![]() 原子晶体中,成键的原子半径越小,则键长越小、键能越大,其硬度就越大。所以
原子晶体中,成键的原子半径越小,则键长越小、键能越大,其硬度就越大。所以![]() 和
和![]() 中硬度较高的是
中硬度较高的是![]() 原因是两者同属原子晶体,C的原子半径小于Si,与
原因是两者同属原子晶体,C的原子半径小于Si,与![]() 相比,
相比,![]() 的键长短、键能大;
的键长短、键能大;
![]() 由结构可知,每个碳原子与3个氮原子形成2个单键和1个双键,由于氮元素的非金属性强于碳元素,故碳元素显
由结构可知,每个碳原子与3个氮原子形成2个单键和1个双键,由于氮元素的非金属性强于碳元素,故碳元素显![]() 价、氮元素显
价、氮元素显![]() 价,由此可判断出该化合物的化学式为
价,由此可判断出该化合物的化学式为![]() 三聚氰胺的环中N原子形成2个
三聚氰胺的环中N原子形成2个![]() 键,含有1对孤电子对,杂化轨道数目为3,采取
键,含有1对孤电子对,杂化轨道数目为3,采取![]() 杂化,氨基中N原子形成3个
杂化,氨基中N原子形成3个![]() 键,含有1对孤电子对,杂化轨道数目为4,采取
键,含有1对孤电子对,杂化轨道数目为4,采取![]() 杂化;
杂化;
![]() 氢键发生在非金属强的原子和氢原子之间,在该物质中氢键可表示为
氢键发生在非金属强的原子和氢原子之间,在该物质中氢键可表示为![]() ;
;
![]()
 分子中三个C原子采取
分子中三个C原子采取![]() 杂化,每个C原子都有1个p电子,形成3个
杂化,每个C原子都有1个p电子,形成3个![]() 键的N原子采取
键的N原子采取![]() 杂化,含有1对p电子,形成2个
杂化,含有1对p电子,形成2个![]() 键的N原子采取
键的N原子采取![]() 杂化,含有1个p电子,五个原子上的6个p电子参与形成离域
杂化,含有1个p电子,五个原子上的6个p电子参与形成离域![]() 键,可表示为
键,可表示为![]() ;
;
![]() 从该晶胞中原子的坐标参数可知,碳原子位于晶胞的8个顶点和6个面心。每个顶点参与形成8个晶胞,每个面心参与形成2个晶胞,根据均摊法可以计算出一个晶胞中有4个碳原子,而4个硅原子位于晶胞内部,所以SiC立方晶胞中含有4个Si原子、4个C原子。
从该晶胞中原子的坐标参数可知,碳原子位于晶胞的8个顶点和6个面心。每个顶点参与形成8个晶胞,每个面心参与形成2个晶胞,根据均摊法可以计算出一个晶胞中有4个碳原子,而4个硅原子位于晶胞内部,所以SiC立方晶胞中含有4个Si原子、4个C原子。


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:
【题目】有机物A 的结构简式为![]() ,它可通过不同化学反应分别制得B、C、D和E四种物质。
,它可通过不同化学反应分别制得B、C、D和E四种物质。

请回答下列问题:
(1)在A~E五种物质中,互为同分异构体的是______(填字母代号)。
(2)写出由A生成B的化学方程式:________________。
(3)已知HCHO分子中所有原子在同一平面内,则上述分子中所有的原子有可能都在同一平面内的是______(填字母代号)。
(4)C能形成高聚物,该高聚物的结构简式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是由1~18号元素中部分元素组成的一些单质及其化合物之间的转化关系图。常温常压下,D、F、K均为无色无刺激性气味的气体,B是最常见的无色液体,A是由单质C在D中燃烧生成的淡黄色固体。(反应中生成的部分物质已略去)
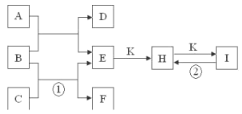
请回答下列问题:
(1)物质A的化学式为_______。
(2)化合物E溶于水中的电离方程式为_________________________________。
(3)实验室将物质C通常保存在_______中,请写出反应①的离子方程式,并用单线桥标出电子转移的方向和数目_____________________________。
(4)反应②的化学方程式为____________________。
(5)有两个分别装有H和I固体的试剂瓶,因标签脱落而无法区分。若让你鉴别它们,下列试剂或方法中可选用的有________.
A.澄清石灰水 B.稀盐酸 C.加热,称重 D.焰色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校探究性学习小组用已部分生锈的废铁屑制作印刷电路板的腐蚀剂,并回收铜。探究过程如下:
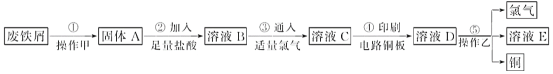
请回答下列问题:
(1)若溶液B中只含有Fe2+而不含Fe3+,可证明该事实的实验方法是________(填序号)。
A.先加氯水,后加KSCN溶液后显红色
B.先加KSCN溶液,不显红色,再加氯水后显红色
C.④只滴加KSCN溶液不显红色
(2)步骤④的化学方程式为_____________________________。
(3)若除去氯化亚铁中氯化铁可以加入试剂________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以烃A为原料合成医用麻醉药苄佐卡因和食品防腐剂尼泊金酸乙酯的路线如下:
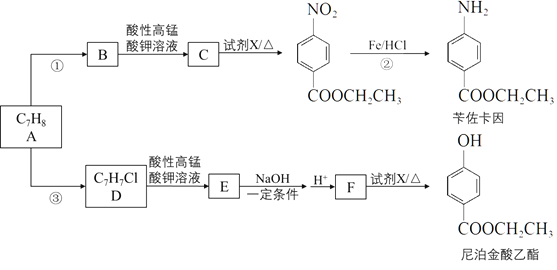
完成下列填空
(1)A的结构简式是____________。工业上A的来源通常是_______________。
(2)反应①的化学方程式是_____________________。
(3)反应②的反应类型是____________。
(4)反应③的试剂与条件是_______________。
(5)F的结构简式是_____________________。
(6)尼泊金酸乙酯有多种同分异构体,任写一种符合下列要求的同分异构体的结构简式____________。
i. 能发生银镜反应且分子中不含甲基
ii. 苯环上有两个对位取代基
(7)以A为起始原料,可以合成涂改液的主要成分亚甲基环己烷(![]() ),写出其合成线路。___________________。
),写出其合成线路。___________________。
(合成路线常用的表示方式为:![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】开发新型储氢材料是开发利用氢能的重要研究方向。
(1)![]() 是一种储氢材料,可由
是一种储氢材料,可由![]() 和
和![]() 反应制得。
反应制得。
①基态Cl原子中,电子占据的最高电子层符号为 ______,该电子层具有的原子轨道数为 _______。
②Li、B、H元素的电负性由大到小的排列顺序为 ___________。
(2)金属氢化物是具有良好发展前景的储氢材料。
①LiH中,离子半径:Li+ ___________(填“>”“=”或“<”)H-。
②某储氢材料是短周期金属元素M的氢化物。M的部分电离能如表所示:
|
|
|
|
|
738 | 1451 | 7733 | 10540 | 13630 |
则M是 ______________ (填元素名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某城市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题
(1)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
浓度/mol·L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断待测试样为__(填“酸”或“碱”)性,表示该试样酸碱性的c(H+)或c(OH-)=___mol·L-1。
(2)煤燃烧排放的烟气中含有SO2和NOx,易形成酸雨,污染大气,采用NaClO2溶液在碱性条件下可对烟气进行脱硫,脱硝,效果非常好。完成下列对烟气脱硝过程的离子方程式。
(____)ClO2-+(____)NO+(____)OH-=(____)Cl-+(____)NO3-+______
(3)为减少SO2对环境的污染,常将煤炭转化为清洁的气体燃料,并将烟气进行处理,吸收其中的SO2。
①写出焦炭与水蒸气反应的化学方程式:__。
②以下物质可以用来吸收烟气中SO2的是__(填字母代号)。
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(4)汽车尾气中NOx和CO的生成及转化。
①汽车启动时汽缸温度高,汽缸中会生成NO,化学方程式为___。
②汽车燃油不完全燃烧时产生CO。在汽车尾气系统中装上催化转化器可使CO和NO反应转化为无污染、无毒性的两种气体,其化学反应方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室模拟工业漂白液(有效成分为NaClO)脱除废水中氨氮(NH3)的流程如下:
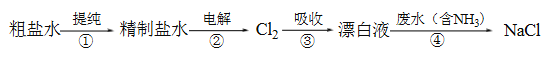
下列分析正确的是
A. ①中采用蒸馏的方法精制粗盐水
B. ②中阳极的主要电极反应:4OH- - 4e- = 2H2O + O2↑
C. ③中制备漂白液的反应:Cl2 + OH- = Cl- + HClO
D. ②、③、④中均发生了氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
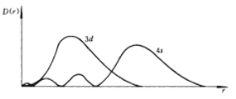
【题目】(1)如图为4s和3d电子云的径向分布图,3d轨道离原子核更近,但是根据鲍林的轨道近似能级图填充电子时,先填4s电子,而后填3d电子,试简单写出理由______。
(2)写出臭氧的Lewis结构式______![]() 只需要写出一种共振式即可
只需要写出一种共振式即可![]() 。
。
(3)根据堆积原理,可以将等径球的密堆积分为![]() 、
、![]() 、
、![]() 、
、![]() 堆积,其中
堆积,其中![]() 堆积形成抽出立方面心晶胞,又叫面心立方最密堆积,其构成的晶胞中含有4个球,写出它们的分数坐标为______。
堆积形成抽出立方面心晶胞,又叫面心立方最密堆积,其构成的晶胞中含有4个球,写出它们的分数坐标为______。
(4)关于![]() 是一个特殊的物质,高温下顺磁性,低温下抗磁性,主要是因为
是一个特殊的物质,高温下顺磁性,低温下抗磁性,主要是因为![]() 与
与![]() 可以相互转化,低温时主要以双聚分子
可以相互转化,低温时主要以双聚分子![]() 形式存在,高温时主要以单分子
形式存在,高温时主要以单分子![]() 形式存在,同时在高温时
形式存在,同时在高温时![]() 分子中存在离域
分子中存在离域![]() 键的存在,使得氧原子没有成单电子,写出
键的存在,使得氧原子没有成单电子,写出![]() 中存在离域
中存在离域![]() 键为______。
键为______。
(5)在相同的杂化类型和相同的孤对电子对数目时,分子的键角也会不相同,试比较![]() 和
和![]() 中键角的大小,
中键角的大小,![]() ______
______![]() 填“大于”或“小于”或“等于”
填“大于”或“小于”或“等于”![]() 。
。
(6)已知饱和硫化氢的浓度为![]() ,硫化氢的离解常数为
,硫化氢的离解常数为![]() ,
,![]() ,计算饱和硫化氢溶液中氢离子的浓度为______。
,计算饱和硫化氢溶液中氢离子的浓度为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com