
| A. | 11% | B. | 19% | C. | 40% | D. | 50% |
分析 C4H10→CH4+C3H6,C4H10→C2H6+C2H4,丁烷的裂化率为90%,设C4H10有1mol,则裂化了0.9mol,剩余0.1mol,裂化生成的烷烃共0.9mol,烯烃共0.9mol,裂化生成的两种烯烃质量相等,即C3H6与C2H4物质的量之比为2:3,即C3H6为0.36mol,C2H4为0.54mol,则同时得到CH4为0.36mol,C2H6为0.54mol,裂化后得到的分子量最小的气体,即CH4,由此分析解答.
解答 解:C4H10→CH4+C3H6,C4H10→C2H6+C2H4,丁烷的裂化率为90%,设C4H10有1mol,则裂化了0.9mol,剩余0.1mol,裂化生成的烷烃共0.9mol,烯烃共0.9mol,裂化生成的两种烯烃质量相等,即C3H6与C2H4物质的量之比为2:3,即C3H6为0.36mol,C2H4为0.54mol,则同时得到CH4为0.36mol,C2H6为0.54mol,裂化后得到的分子量最小的气体,即CH4,占混和气体的体积百分含量最接近于=$\frac{0.36}{0.1+0.9+0.9}$×100%=18.95%,故选B.
点评 本题考查化学方程式有关计算,为高频考点,侧重考查学生分析计算能力,明确烷烃裂解原理是解本题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | C2H5OH在电池的负极上参加反应 | |
| B. | 1 mol乙醇被氧化转移6 mol电子 | |
| C. | 在外电路中电子由负极沿导线流向正极 | |
| D. | 电池正极得电子的物质是O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
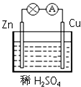
| A. | H2-2e-═2H+ | B. | Cu-2e-═Cu2+ | C. | 2H++2e-═H2↑ | D. | Zn-2e-═Zn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
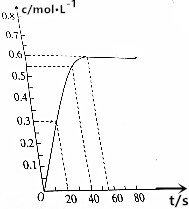 298K时,在2L的恒容密闭容器中,发生可逆反应:2NO2(g)?N2O4(g).N2O4的物质的量浓度随时间的变化如图.达到平衡时N2O4的浓度为NO2的2倍.
298K时,在2L的恒容密闭容器中,发生可逆反应:2NO2(g)?N2O4(g).N2O4的物质的量浓度随时间的变化如图.达到平衡时N2O4的浓度为NO2的2倍.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A的能量一定高于C | |
| B. | A和B的总能量一定低于C和D的总能量 | |
| C. | A和B的总能量一定高于C和D的总能量 | |
| D. | 该反应为放热反应,故不必加热就一定能发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 |
| A | 加热放在坩埚中的小块钠 | 钠先熔化成光亮的小球,燃烧时火焰为黄色,燃烧后生成淡黄色固体 |
| B | 在酒精灯上加热铝箔 | 铝箔熔化,失去光泽,熔化的铝滴落下来 |
| C | 向久置于空气中的FeSO4溶液中滴加NaOH溶液 | 立刻产生大量白色沉淀 |
| D | 向饱和Na2CO3溶液中通入足量的CO2气体 | 无明显现象 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| a | 该元素能形成多种单质,其中一种是自然界中硬度最大的物质 |
| b | 其单质是空气中的主要成分,不能支持燃烧 |
| c | 最外层电子数是次外层电子数的3倍 |
| d | 短周期中最活泼的金属 |
| e | 与a是同主族元素 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
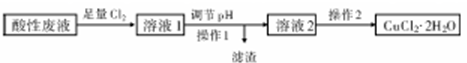
 Cu(OH)2+2H+,增大氢离子浓度,抑制Cu2+水解(结合离子方程式并简要说明).
Cu(OH)2+2H+,增大氢离子浓度,抑制Cu2+水解(结合离子方程式并简要说明).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com