
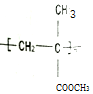
 )缩写代号为PMMA.俗称有机玻璃.下列说法中错误的是( )
)缩写代号为PMMA.俗称有机玻璃.下列说法中错误的是( )| A. | 合成PMMA的单体是甲基丙烯酸和甲醇 | |
| B. | 聚甲基丙烯酸甲酯的分子式可表示为(C5H8O2)n | |
| C. | 聚甲基丙烯酸甲酯属于有机高分子合成材料 | |
| D. | 甲基丙烯酸甲酯[CH2=C(CH3)COOCH3]中碳原子可能都处于同一平面 |
分析 聚甲基丙烯酸甲酯为加聚反应产物,单体为CH2=C(CH3)COOCH3,单体中碳碳双键、C=O均为平面结构,且直接相连,以此来解答.
解答 解:A.聚甲基丙烯酸甲酯的单体为CH2=C(CH3)COOCH3,故A错误;
B.由结构可知,聚甲基丙烯酸甲酯的分子式可表示为(C5H8O2)n,故B正确;
C.聚甲基丙烯酸甲酯的相对分子质量在10000以上,属于有机高分子合成材料,故C正确;
D.甲基丙烯酸甲酯中碳碳双键、C=O均为平面结构,且直接相连,则碳原子可能都处于同一平面,故D正确;
故选A.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、加聚反应中单体的判断等为解答的关键,侧重分析与应用能力的考查,注意原子共面判断为解答的难点,题目难度不大.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
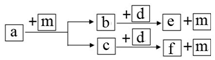 短周期元素 W、X、Y、Z 的原子序数依次递增,a、b、c、d、e、f 是由这些元素组成的化合物,d 是淡黄色粉末,m 为元素 Y 的单质,通常为无色无味的气体.上述物质的转化关系如图所示.下列说法错误的是( )
短周期元素 W、X、Y、Z 的原子序数依次递增,a、b、c、d、e、f 是由这些元素组成的化合物,d 是淡黄色粉末,m 为元素 Y 的单质,通常为无色无味的气体.上述物质的转化关系如图所示.下列说法错误的是( )| A. | 简单离子半径:Z<Y | B. | 阴离子的还原性:Y>W | ||
| C. | 简单气态氢化物的热稳定性:Y>X | D. | W2Y2 中含有非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
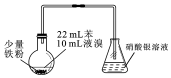
| A. | 制备溴苯的反应属于取代反应 | |
| B. | 烧瓶中反应发生后,有白雾产生,继而充满红棕色气体 | |
| C. | 实验加入试剂的顺序可以是:苯、液溴、铁粉 | |
| D. | 为了增强验证HBr的实验效果,可将锥形瓶中的导管插入溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁制品在潮湿空气中更易锈蚀 | |
| B. | 二氧化硅常用于制造光导纤维 | |
| C. | 实验室中经过滤可得到纳米碳酸钙固体 | |
| D. | 聚乙烯可作食品包装材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验操作 | |
| A | 制备Fe(OH)3胶体 | 将NaOH浓溶液滴加到热饱和FeCl3溶液中 |
| B | 由MgCl2溶液制备无水MgCl2 | 将MgCl2溶液加热蒸干 |
| C | “侯氏制碱法”过程中制取NaHCO3 | 将过量CO2通入到NH3和食盐的饱和溶液中 |
| D | 证明CH3COOH是弱酸 | 将CH3COOH与Na2CO3溶液反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NaOH+H2SO4═Na2SO4+2H2O | B. | 2SO2+O2+2H2O═2H2SO4 | ||
| C. | Cu+2H2SO4$\frac{\underline{\;△\;}}{\;}$CuSO4+SO2↑+2H2O | D. | C+2H2SO4(浓)$\frac{\underline{\;△\;}}{\;}$2SO2↑+CO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | 杂质 | 除杂试剂或操作方法 | |
| A. | CuSO4 | FeSO4 | 加入过量铁粉,过滤 |
| B. | NaNO3 | CaCO3 | 溶解、过滤、蒸发 |
| C. | NaCl溶液 | I2 | 加酒精,萃取分液 |
| D. | KNO3溶液 | AgNO3 | 加入NaCl溶液,过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com