
分析 (1)铜和浓硝酸反应生成硝酸铜、二氧化氮和水,二氧化氮是红棕色气体,铜盐溶液呈篮色;
(2)铜有剩余,铜和稀硝酸反应生成硝酸铜和NO;
(3)酸性条件下,硝酸根离子具有强氧化性,又继续和铜反应.
解答 解:(1)铜和浓硝酸反应生成硝酸铜、二氧化氮和水,反应方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,二氧化氮是红棕色气体,铜盐溶液呈篮色,所以看到的现象是:溶液逐渐变篮色,有红棕色气体逸出,
故答案为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;溶液逐渐变篮色,有红棕色气体逸出;
(2)铜有剩余,随着反应的进行,硝酸浓度逐渐减小,当变为稀硝酸时,铜和稀硝酸反应生成硝酸铜和NO,反应方程式为3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,
故答案为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;
(3)加入稀硫酸后,氢离子原溶液中硝酸根离子构成强氧化性酸,又能与过量的铜反应,发生的反应为3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,
故答案为:加入稀硫酸后,氢离子与原溶液中硝酸根离子构成强氧化性酸,又能与过量的铜反应.
点评 本题考查了硝酸的性质,硝酸的浓度不同导致其氧化性不同,和铜反应时其产物不同,酸性条件下硝酸根离子具有强氧化性,题目难度不大.


科目:高中化学 来源: 题型:解答题
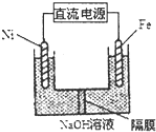
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp(25℃) | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的pH范围 | ≥9.0 | ≥6.7 | ≥3.2 |
| A. | 向该混合溶液中逐滴加入NaOH溶液,最先看到白色沉淀 | |
| B. | PH=10时溶液中c(Cu2+):c(Fe2+:c(Fe3+)=(2.2×10-20):(8.0×10-16 ):( 4.0×10-34 ) | |
| C. | 该溶液中2c(SO42-)=2c(Cu2+)+2c(Fe2+)+3c(Fe3+) | |
| D. | 通入氨气将该溶液的PH调节到9后所得沉淀经过过滤、洗涤、干燥、灼烧,可得三种金属氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
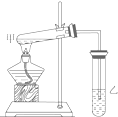 如图是某学生设计的制取乙酸乙酯的实验装置图,实验中采取了以下主要实验操作:
如图是某学生设计的制取乙酸乙酯的实验装置图,实验中采取了以下主要实验操作:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.8×10-2 mol•L-1 | B. | 1.4×10-5 mol•L-1 | ||
| C. | 2.8×10-5 mol•L-1 | D. | 5.6×10-5 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 C60、N60为新发现的有特殊用途的单质、分子结构均如图所示.研究表明,C60、N60分子中所有均达到8电子稳定结构.
C60、N60为新发现的有特殊用途的单质、分子结构均如图所示.研究表明,C60、N60分子中所有均达到8电子稳定结构.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用碱式滴定管量取20mL0.1000mol/LKMnO4溶液 | |
| B. | 只用浓氨水就可以鉴别NaCl、AlCl3、MgCl2、Na2SO4四种溶液 | |
| C. | 用四氯化碳萃取溴水中的溴并分液,有机层应从分液漏斗的上口倒出 | |
| D. | 测定中和反应的反应热时,将碱缓缓倒入酸中,测出的温度变化值偏小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com