
| A. | 明矾投入水中的电离方程式为:KAI(SO4)2•12H2O=K++Al3++2SO42-+12H20,说明明矾是一种混合物 | |
| B. | 净水时Al3+发生水解生成的是Al(OH)3沉淀 | |
| C. | 明矾净水的原理是杀菌消毒 | |
| D. | 硫酸铁可以代替明矾进行净水 |
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:选择题
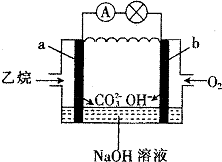
| A. | a为负极,电极反应式为CH3CH3-14e-+18OH-═2CO32-+12H2O | |
| B. | 电子从a极经导线移向b极,再经溶液移向a极 | |
| C. | 电池工作一段时间后电解质溶液的pH增大 | |
| D. | 用该电池电解硫酸铜溶液(电解池的电极为惰性电极),消耗氧气的物质的量与析出铜的物质的量之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用大量SO2漂白银耳 | |
| B. | 用小苏打(NaHCO3)焙制糕点 | |
| C. | 硅胶常用作食品、药品干燥剂 | |
| D. | 用消毒液(有效成分NaClO)对餐具进行杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
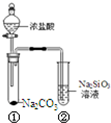
| A. | 向Na2SiO3溶液中滴入酚酞溶液无明显现象 | |
| B. | 试管①中反应的离子方程式是:Na2CO3+2H+═2Na++CO2↑+H2O | |
| C. | 该实验可以证明酸性:盐酸>碳酸>硅酸 | |
| D. | 若将盐酸换成硫酸,能证明酸性:硫酸>碳酸>硅酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
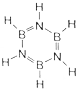 氮元素是一种常见元素,能形成多种化合物.
氮元素是一种常见元素,能形成多种化合物.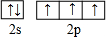 ,等物质的量的NH3和N2组成的混合气体中σ键和π键的物质之比为2:1.
,等物质的量的NH3和N2组成的混合气体中σ键和π键的物质之比为2:1.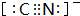 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有SO42- |
| B | 向某溶液中加入2滴KSCN溶液不显红色.再向溶液中加入几滴新制氯水,溶液变为红色. | 该溶液中一定含有 Fe2+ |
| C | 将某气体通入到品红溶液中,品红褪色 | 该气体一定为SO2 |
| D | 向某溶液中滴入盐酸,产生能使澄清石灰水变浑浊的无色无味气体 | 该溶液中一定含有CO32- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
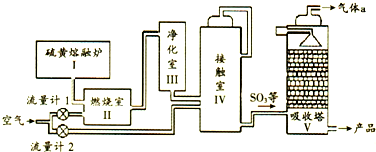
| A. | Ⅱ中主要反应的热化学方程式:S(s)+O2(g)?SO3(g)△H=-297kJ•mol-1S(s)+O2(s)=SO2(g)△H=-297kJ•mol-1 | |
| B. | Ⅳ中主要反应的化学方程式:2SO2+O2(s) $?_{△}^{催化剂}$SO3 | |
| C. | Ⅳ中使用催化剂可提高化学反应速率和平衡转化率 | |
| D. | Ⅴ中气体a 可以直接排放到大气中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com