
| A. | 苯分子中无碳碳双键,苯不能发生加成反应 | |
| B. | 甲烷能与氯水发生取代反应 | |
| C. | 乙醇在一定条件下能被氧化成乙醛 | |
| D. | 乙烯和苯均能与溴水反应而使其褪色 |
科目:高中化学 来源: 题型:选择题
| 选项 | 分子式 | 同分异构体数目 |
| A | CH2F2 | 2种 |
| B | C2H6O | 3种 |
| C | C3H7Cl | 4种 |
| D | C4H8 | 5种 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
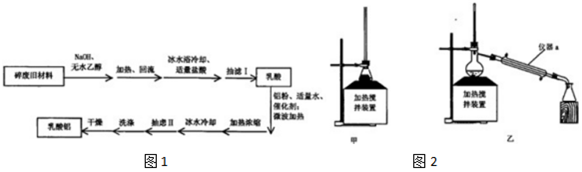
 $→_{②HCl}^{①NaOH}$CH3CH(OH)COOH$\stackrel{Al}{→}$Al[CH3CH(OH)COO]3
$→_{②HCl}^{①NaOH}$CH3CH(OH)COOH$\stackrel{Al}{→}$Al[CH3CH(OH)COO]3| 编号 | 时间/h | n(乳酸):n(铝) | ?(乳酸) | 产率(%) | 编号 | 时间/h | n(乳酸):n(铝) | ?(乳酸) | 产率(%) |
| 1 | 8 | 3.025 | 0.10 | 64.0 | 4 | 10 | 2.935 | 0.20 | 78.4 |
| 2 | 8 | 3.025 | 0.20 | 72.0 | 5 | 10 | 3.025 | 0.20 | 90.2 |
| 3 | 8 | 3.025 | 0.30 | 68.5 | 6 | 10 | 3.505 | 0.20 | 91.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的A、B两种烃分别完全燃烧后,生成的CO2与消耗的O2的物质的量均相同,则A和B一定互为同系物 | |
| B. | 沸点比较:正戊烷>异戊烷>新戊烷 | |
| C. | 乙酸与乙醇在一定条件下反应生成乙酸乙酯和水的反应属于取代反应 | |
| D. | 判断苯分子中不存在碳碳单键与碳碳双键的交替结构的依据是:邻二甲苯只有一种结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 工业燃烧煤、石油等化石燃料释放出大量NOx、CO、CO2等气体,严重污染空气,对废气进行脱硝,脱碳等处理可实现绿色环保、废物利用.
工业燃烧煤、石油等化石燃料释放出大量NOx、CO、CO2等气体,严重污染空气,对废气进行脱硝,脱碳等处理可实现绿色环保、废物利用.| 容器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO2、3molH2 | amol CO2、3amolH2 bmolCH3OH(g)、bmolH2O(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
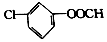 有机物X的结构简式如图所示,1mol X与足量的NaOH溶液在一定的条件下反应,理论上可以消耗NaOH的物质的量为( )
有机物X的结构简式如图所示,1mol X与足量的NaOH溶液在一定的条件下反应,理论上可以消耗NaOH的物质的量为( )| A. | 2mol | B. | 3mol | C. | 4mol | D. | 5mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com