
【题目】下列关于胶体的叙述不正确的是( )
A.将氯化铁饱和溶液煮沸即得氢氧化铁胶体
B.光束通过稀豆浆时会产生丁达尔效应
C.分散质粒子大小介于1nm~100nm之间的分散系属于胶体
D.胶体粒子很小,可以透过滤纸
科目:高中化学 来源: 题型:
【题目】下列关于物质性质的比较,不正确的是( )
A.原子半径大小:Na>P>S
B.非金属性强弱:I>Br>Cl
C.氧化性强弱:F2>Cl2>Br2
D.金属性强弱:Na>Mg>Al
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既属于氧化还原反应,又属于生成物的总能量大于反应物的总能量的是( )
A.Ba(OH)2·8H2O 与 NH4Cl 的反应B.碳与二氧化碳的反应
C.铝片和稀盐酸反应D.甲烷在氧气中的燃烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,p、q为直流电源的两极,A由金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D上产生气泡,试回答: 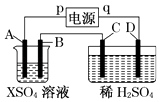
(1)p为极,A极发生了反应.
(2)C为极,可收集到;D为极,可收集到 .
(3)C极的电极反应式为 .
(4)在电解过程中,测C、D两极上产生气体的体积,实验数据如表:
时间(min) | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
阴极产生气体的体积(cm3) | 6 | 12 | 20 | 29 | 39] | 49 | 59 | 69 | 79 | 89 |
阳极产生气体的体积(cm3) | 2 | 4 | 7 | 11 | 16 | 21 | 26 | 31 | 36 | 41 |
仔细分析以上实验数据,请说出变化的可能原因是 .
(5)当反应进行一段时间后,A、B电极附近溶液的pH(填“增大”“减小”或“不变”).
(6)当电路中通过0.004mol电子时,B极上沉积的金属X为0.128g,则此金属的摩尔质量为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下图所示的装置制取少量溴苯。

请回答下列问题:
(1)在烧瓶a中反应的化学方程式是__________________________________________。
(2)与烧瓶口垂直的一段长导管的作用是______________________________________。
(3)锥形瓶C中盛放四氯化碳的作用是________________________________________。
(4)能证明苯和液溴发生的是取代反应,而不是加成反应,可向锥形瓶C中加入硝酸银溶液,若________,则能证明。另一种验证的方法是向锥形瓶C中加入________________________,现象是________________________________________________________________________。
(5)生成的溴苯因溶有未反应的溴而显褐色,提纯的方法是____________________________。
(6)实验结束时,将氢氧化钠溶液倒入烧瓶中,充分振荡,目的是_________________________,反应的化学方程式是_____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应A2+ B2= 2AB的能量变化如图所示,则下列说法正确的是( )
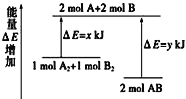
A. 该反应是吸热反应
B. 断裂1 mol A—A键和1 mol B—B键能放出x kJ的能量
C. 断裂2 mol A—B键需要吸收y kJ的能量
D. 2 mol AB的总能量高于1 mol A2和1 mol B2的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在生物体内含量极少,但对于维持生物体的正常生命活动必不可少的元素有( )
A. Zn、Cu、B、Mn
B. Zn、Cu、Mg、Ca
C. Fe、Mn、Zn、Mg
D. Mg、Mn、Cu、Mo
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.氨是一种重要的工业原料。回答下列问题:
(1)催化剂存在下,NH3可用来消除NO的污染,生成两种对环境无害的物质。写出反应的化学方程式____________;该反应中氧化产物与还原产物的物质的量之比为____。
(2)当运输氨气的管道发生泄漏时,可用一种挥发性液体________(写试剂名称) 进行检查,出现的现象是___________________________________。
II.联氨(N2H4)具有较强的还原性。工业上用过量氨气和NaClO溶液来制备。
(1)制取NaClO所用的原料是_________、_________。解释氨气过量的原因_________。
常温下,向10mL pH=2的盐酸中滴加等浓度氨水。加入氨水的体积(V)与溶液pH的关系如图所示。
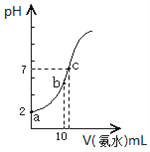
(2)a点溶液中由水电离产生的c(H+)___10-7mol/L (填>、<或=);用平衡移动原理解释b点溶液呈酸性的原因___________。
(3)比较c点溶液中所有离子浓度大小关系是_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com