
【题目】某化学兴趣小组为研究生铁(含碳)与浓硫酸的反应情况及产物性质,设计如下实验。请回答下列问题:
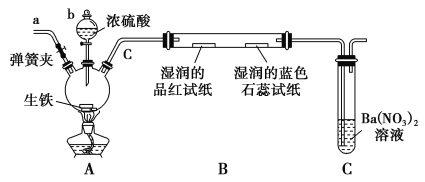
(1)按上图所示装置进行实验(夹持装置及尾气处理装置未画出)。仪器b的名称为________;实验过程中,装置B中观察的现象是______________________。
(2)装置C中有白色沉淀生成,该反应化学方程式为_______________________。
(3)装置A中还会产生CO2气体,请写出产生CO2的化学方程式:_______________________。
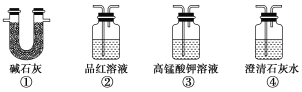
(4)为了验证装置A中产生的气体中含有CO2,应先从下列①~④中选出必要的装置连接A装置中c处管口,从左到右的顺序为________(填序号);然后再进行的操作是从a处多次鼓入N2,其目的是___________________________。
(5)某同学通过验证实验后期装置A中产生的气体中还含有H2,反应的离子方程式是____________________________。
【答案】(1)分液漏斗 品红试纸褪色,石蕊试纸变红
(2)Ba(NO3)2+3SO2+2H2O===BaSO4↓+2NO+2H2SO4(书写2个方程式也可)
(3)C+2H2SO4(浓) ![]() CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
(4)③②④ 赶尽装置中的空气,防止空气的CO2影响实验
(5)Fe+2H+===Fe2++H2↑
【解析】该实验的原理为
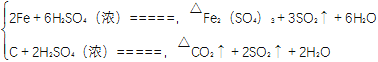 ,利用CO2和SO2的性质进行检验,(1)根据仪器的结构特点,b的名称为分液漏斗;结合SO2的化学性质,装置B中湿润的品红试纸褪色,湿润的蓝色石蕊试纸变红;(2)装置C中有白色沉淀的原因是SO2与水反应生成H2SO3,遇到Ba(NO3)2溶液被NO
,利用CO2和SO2的性质进行检验,(1)根据仪器的结构特点,b的名称为分液漏斗;结合SO2的化学性质,装置B中湿润的品红试纸褪色,湿润的蓝色石蕊试纸变红;(2)装置C中有白色沉淀的原因是SO2与水反应生成H2SO3,遇到Ba(NO3)2溶液被NO![]() 氧化为SO
氧化为SO![]() ,SO
,SO![]() +Ba2+===BaSO4↓,该反应的化学方程式为Ba(NO3)2+3SO2+2H2O===BaSO4↓+2NO+2H2SO4;(3)生铁中的炭与浓硫酸反应会产生CO2,其化学方程式为C+2H2SO4(浓)
+Ba2+===BaSO4↓,该反应的化学方程式为Ba(NO3)2+3SO2+2H2O===BaSO4↓+2NO+2H2SO4;(3)生铁中的炭与浓硫酸反应会产生CO2,其化学方程式为C+2H2SO4(浓) ![]() CO2↑+2SO2↑+2H2O;(4)检验CO2通常用澄清的石灰水,检验前要排除SO2的干扰,并保证除净,要用到KMnO4溶液和品红溶液,从左到右的顺序为③②④;由于装置中有空气,而空气中的CO2对实验有影响,应从a处多次鼓入N2,赶尽装置中的空气;(5)反应后期浓硫酸会变稀,Fe与稀H2SO4反应会产生H2,反应的离子方程式是Fe+2H+===Fe2++H2↑。
CO2↑+2SO2↑+2H2O;(4)检验CO2通常用澄清的石灰水,检验前要排除SO2的干扰,并保证除净,要用到KMnO4溶液和品红溶液,从左到右的顺序为③②④;由于装置中有空气,而空气中的CO2对实验有影响,应从a处多次鼓入N2,赶尽装置中的空气;(5)反应后期浓硫酸会变稀,Fe与稀H2SO4反应会产生H2,反应的离子方程式是Fe+2H+===Fe2++H2↑。


科目:高中化学 来源: 题型:
【题目】某氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按如图所示步骤进行操作。下列说法中正确的是( )
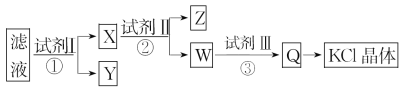
A.起始滤液的pH=7
B.试剂Ⅰ为Ba(NO3)2溶液
C.步骤②中加入试剂Ⅱ的目的是除去B![]()
D.图示的步骤中必须要经过2次过滤操作
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在提纯混有少量氯化钾的硝酸钾时,第一步操作应
A.在常温下将混合物溶于水中形成浓溶液
B.在常温下将混合物溶于水中形成稀溶液
C.在较高温度下将混合物溶于水中形成浓溶液
D.在较高温度下将混合物溶于水中形成稀溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种新型无机非金属材料,某AlN样品仅含有Al2O3杂质,为测定AlN的含量,设计如下实验方案。
(1)实验原理。
AlN溶于浓的强碱生成氨气,请写出AlN与NaOH溶液反应的化学方程_________。
(2)实验装置。

如图C装置中球形干燥管的作用是_________________________。
(3)实验过程。
①连接好实验装置________,然后称得C装置的质量为yg。
②称取xg AlN样品置于A装置中;塞好胶塞,关闭________打开________(填“K1”或“K2”);通过分液漏斗加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,称得C装置的质量变为zg,通入氮气的目的是__________________,装置B的作用是__________________________。
(4)数据分析。
①AlN的质量分数为________。(相对原子质量Al:27,N:14)
②由于装置存在缺陷,导致测定结果偏高,请提出改进意见________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于燃料充分利用的说法错误的是( )
A.热能要充分利用
B.燃料充分燃烧时输入的空气量越多越好
C.固体燃料燃烧前要粉碎
D.液体燃料燃烧时可以雾状喷出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水在25℃和95℃时,其电离平衡曲线如图所示.
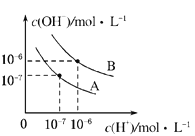
(1)95℃时水的电离平衡曲线应为______(填“A”或“B”),理由是______.
(2)曲线A所对应的温度下,pH=2的HCl溶液和pH=12的某BOH溶液中,若水的电离程度分别用α1、α2表示,则α1______α2(填“大于”、“小于”、“等于”或“无法确定”,下同),若将二者等体积混合,则混合溶液的pH______7.
(3)在曲线B所对应的温度下,将0.02molL﹣1的Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合,所得混合液的pH=______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中进行反应:2SO2(g)+O2(g) ![]() 2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.4mol/L、0.2mol/L、0.4mol/L,当反应达平衡时,可能存在的数据是
2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.4mol/L、0.2mol/L、0.4mol/L,当反应达平衡时,可能存在的数据是
A. SO2为0.8mol/L,O2为0.4mol/L
B. SO2为0.5mol/L
C. SO3为0.8mol/L
D. SO2、SO3一定均为0.3mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.可用磨口玻璃瓶保存NaOH溶液
B.使用容量瓶配制100g 36%的NaCl溶液
C.稀硝酸可除去试管内壁的银镜
D.加热可除去NaHCO3固体中混有的Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2NO2![]() 2NO+O2在恒容密闭容器中进行,下列情况达到平衡状态的是
2NO+O2在恒容密闭容器中进行,下列情况达到平衡状态的是
①单位时间内生成n mol O2的同时生成2n mol NO2
②混合气体的平均相对分子质量不再改变
③NO2、NO、O2的反应速率之比为2∶2∶1
④混合气体的颜色不再改变
⑤混合气体的密度不再改变
A.①②④ B.②③⑤ C.①②⑤ D.①②④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com