
【题目】能正确表示下列变化的方程式是
A.HSO3-电离:HSO3-+H2O![]() SO32-+ H3O+
SO32-+ H3O+
B.NaHCO3溶液中加入少量盐酸:CO32-+2H+=CO2↑+ H2O
C.KI 溶液中加入 H2SO4 和 H2O2: 2I-+H2O2 =I2+2OH-
D.用石墨电极电解 CuCl2溶液 :Cu2++2C1-+2H2O![]() Cu(OH)2↓+H2↑ + Cl2 ↑
Cu(OH)2↓+H2↑ + Cl2 ↑
【答案】A
【解析】
A.HSO3-电离:HSO3-![]() SO32-+ H+,H+在水溶液中以H3O+的形式存在,所以也可以表示为HSO3-+H2O
SO32-+ H+,H+在水溶液中以H3O+的形式存在,所以也可以表示为HSO3-+H2O![]() SO32-+ H3O+,A正确;
SO32-+ H3O+,A正确;
B.NaHCO3在水中电离出Na+和HCO3-,HCO3-不能完全电离,所以NaHCO3溶液中加入少量盐酸,反应的离子方程式为:HCO3-+H+=CO2↑+ H2O,B错误;
C.KI和H2O2发生氧化还原反应,溶液中加入H2SO4,溶液是酸性的,离子方程式应为:2I-+H2O2+2H+ =I2+2H2O,C错误;
D.用石墨电极电解 CuCl2溶液,在阴极放电的是铜离子,电解方程式为:Cu2++2C1-![]() Cu + Cl2 ↑,D错误;
Cu + Cl2 ↑,D错误;
故选A。


科目:高中化学 来源: 题型:
【题目】氧化还原反应与四种基本类型反应的关系如下图所示,则下列化学反应属于阴影部分的是( )

A.CO + CuO ![]() CO2 + Cu
CO2 + Cu
B.Cu2(OH)2CO3![]() 2CuO+H2O+CO2↑
2CuO+H2O+CO2↑
C.Fe+H2SO4=FeSO4+H2↑
D.N2+3H2 ![]() 2NH3
2NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在HClO4-NaClO4介质中,K5[Co3+O4W12O36](简记为Co3+W)催化氧化NH2OH的过程如下:
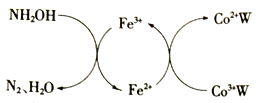
(1)Co2+基态核外电子排布式为________。
(2)NH2OH分子中氮原子轨道的杂化类型是_______,lmolNH2OH分子中含有σ键的数目为_______。
(3)N、H、O三种元素的电负性由小到大的顺序为_________。
(4)ClO4-的空间构型为__________。
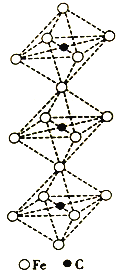
(5)一种铁、碳形成的间隙化合物的晶体结构如右图所示,其中碳原子位于铁原子形成的八面体的中心,每个铁原子又为两个八面体共用,则该化合物的化学式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3等杂质)为原料冶炼铝的工艺流程如下:

对上述流程中的判断正确的是
A. 试剂X为稀硫酸
B. 结合质子( H+)的能力由强到弱的顺序是:AlO2—> OH— >CO32—
C. 反应II中生成Al(OH)3的反应为:CO2+AlO2- +2H2O =Al(OH)3↓+HCO3-
D. Al2O3熔点很高,工业上还可采用电解熔融AlCl3冶炼Al
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芴酮可用作工程塑料的改进剂。某芴酮可通过下列反应得到:
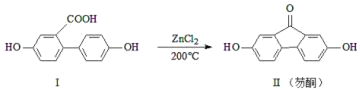
①化合物Ⅱ中含氧官能团为_____和_____(写名称)。
②鉴别化合物Ⅰ和化合物Ⅱ可用的试剂为_____(写化学式)。
③1mol化合物Ⅰ最多可与_____molNaOH完全反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在周期表中的位置关系如图所示,已知在同周期元素的常见简单离子中,W的简单离子半径最小,X、Y、Z、W的单质及其化合物在日常生活中用途极其广泛。

(1)X元素在元素周期表中的位置________。
(2)X、Y、Z元素的简单气态氢化物中,稳定性最差的是________(用分子式表示)。
(3)Y、Z、W三种元素对应的离子中,半径由大到小的顺序____________(用离子符号表示)。
(4)某汽车尾气分析仪以燃料电池为工作原理测定XZ的浓度,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中Z2-可以在固体介质NASICON中自由移动。则负极的反应式_______________。关于该电池的下列说法,正确的是_________。

A.工作时电极b作正极,Z2- 通过固体介质NASICON由电极b流向电极a
B.工作时电流由电极a通过传感器流向电极b
C.传感器中通过的电流越大,尾气中XZ的含量越高
(5)X2Z42-能被酸性KMnO4氧化,请填写相应的离子,并给予配平:
_____ ______+______MnO4- + ________H+ = ______CO2 + _______Mn2++______H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O反应中,
(1) ______ 元素被氧化, ______ 是氧化剂;
(2) ______ 是氧化产物, ______ 发生氧化反应;
(3)被还原的HNO3与参加反应的HNO3物质的量之比是 ______;
(4)用双线桥标出该反应电子转移的方向和数目:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O_________________;
(5)当有8mol HNO3被还原时,反应转移___________个电子;
(6)写出该反应的离子反应方程式___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,两圆圈相交的阴影部分表示圆圈内物质相互发生的反应。钠及其氧化物的物质的量 均为0.1 mol,水的质量为100 g。下列说法正确的是

A.甲、乙、丙都属于氧化还原反应
B.甲反应的离子方程式为Na+2H2O![]() Na++2OH-+H2↑
Na++2OH-+H2↑
C.丙充分反应,能产生0.05 mol O2,转移电子0.1 mol
D.甲、乙、丙充分反应后所得溶液的质量分数分别为w1、w2、w3,则2w1=w2=w3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境监测显示,某地市的主要气体污染物为SO2、NOx、CO等,其主要来源为燃煤、机动车尾气。进行如下研究:
(1)为减少燃煤对SO2的排放,可将煤转化为清洁燃料水煤气(CO和H2)。
已知:![]() ΔH=241.8kJ·mol-1,
ΔH=241.8kJ·mol-1,
![]() ΔH=-110.5kJmol-1
ΔH=-110.5kJmol-1
写出焦炭与1mol水蒸气反应生成水煤气的热化学方程式:________。
(2)汽车尾气中NO是在发动机汽缸中生成的,反应为N2(g)+O2(g)![]() 2NO(g) ΔH>0。
2NO(g) ΔH>0。
①将含0.8molN2和0.2molO2(近似空气组成)的混合气体充入某密闭容器中,保持1300℃反应达到平衡,测得生成8×10-4molNO。计算该温度下此反应的化学平衡常数K=________(填近似计算结果)。
②汽车启动后,汽缸内温度越高,单位时间内NO排放量越大,原因是________.
(3)利用如图所示装置(电极均为惰性电极)可吸收SO2,并利用阴极排出的溶液吸收NO2。
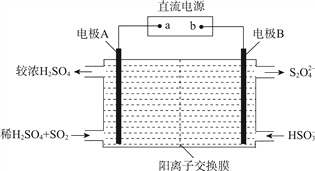
①电极A的电极反应式为________;
电极B的电极反应式为________。
②碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时生成SO32-。该反应的离子方程式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com