
| A. | 次氯酸的结构式:H-Cl-O | B. | 1H、2H、3H是同一种核素 | ||
| C. | S2-的结构示意图: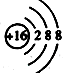 | D. | 四氯化碳的电子式: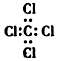 |
分析 A、HClO中Cl原子只能形成1个共价键;
B、具有一定质子数和中子数的原子就是一种核素;
C、硫离子的核内有16个质子,核外有18个电子;
D、四氯化碳的电子式中,氯原子的最外层达到8电子稳定结构,漏掉了氯原子的最外层3对未成键电子;
解答 解:A、HClO中Cl原子只形成1个共价键,即HClO中是H原子和Cl原子分别与O原子形成共价键,故HClO的结构式:H-O-Cl,故A错误;
B、1H、2H、3H为氢元素的3种不同的原子,即三种核素,它们之间互为同位素,故B错误;
C、硫离子的核内有16个质子,核外有18个电子,故硫离子的结构示意图为 ,故C正确;
,故C正确;
D、四氯化碳分子中含有4个碳氯键,碳原子和氯原子最外层达到8电子稳定结构,四氯化碳正确的电子式为: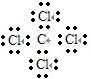 ,故D错误;
,故D错误;
故选C.
点评 本题考查了电子式、结构式和离子的示意图的书写,题目难度不大,注意掌握常见化学用语的概念及正确的书写方法,明确甲烷与四氯化碳的电子式的区别.


科目:高中化学 来源: 题型:解答题
 Ⅰ.铁及铁的化合物应用广泛,如FeCl3可用作印刷电路铜版腐蚀剂和外伤止血剂等.
Ⅰ.铁及铁的化合物应用广泛,如FeCl3可用作印刷电路铜版腐蚀剂和外伤止血剂等.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 实验目的 | 实验操作 | |
| A | 区分苯和四氯化碳 | 在两支分别盛有少量苯和四氯化碳的试管中加碘水后振荡 |
| B | 证明溴乙烷中有溴原子 | 溴乙烷与NaOH水溶液共热,充分反应,冷却后加入硝酸银溶液 |
| C | 制取溴苯 | 在苯中加铁粉后再加溴水并振荡 |
| D | 除去苯中的甲苯 | 向混合物中加入酸性高锰酸钾溶液,然后分液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
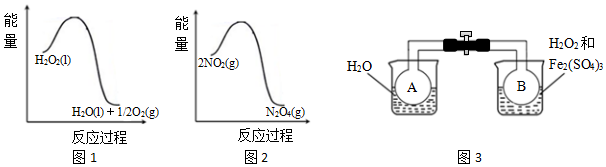
| A. | H2O2中只含有极性共价键,不含离子键 | |
| B. | 2NO2?N2O4的平衡常数K随温度升高而减小 | |
| C. | 向H2O2中加入Fe2(SO4)3后,B中颜色变浅 | |
| D. | H2O2分解反应中Fe2(SO4)3作催化剂,可以使反应的△H减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min | 1 | 2 | 3 | 4 | 5 |
| 氢气体积/mL | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:Na+、Cu2+、Cl-、CO32- | |
| B. | 0.1 mol•L-1 AlCl3溶液中:Cu2+、Mg2+、SO42-、NO3- | |
| C. | 由水电离产生的c(H+)=10-12 mol•L-1的溶液中:NH4+、SO42-、HCO3-、Cl- | |
| D. | 1.0mol/LKNO3溶液中:Fe2+、H+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | X可用于合成高分子化合物,Y不能合成高分子化合物 | |
| B. | X在烧碱溶液中变质,而Y在烧碱溶液中不变质 | |
| C. | X分子中所有原子均可能共平面 | |
| D. | X和Y分别与浓硝酸反应都能生成5种二硝基取代物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+=Cu2++2Fe2+ | |
| B. | Na2O2与H2O反应制备O2:Na2O2+H2O=2Na++2OH-+O2↑ | |
| C. | 硫化钠水溶液呈碱性的原因:S2-+2H2O?H2S↑+2OH- | |
| D. | 铝粉与NaOH溶液反应产生H2:2A1+2OH-+2H2O=2Al(OH)3↓+3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
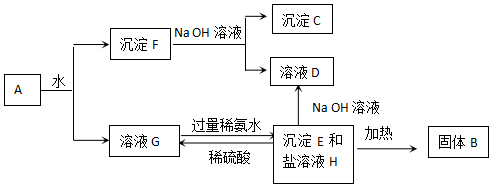
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com