
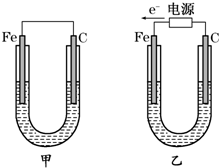
分析 (1)①甲中碳为正极,氢氧根离子失去电子,乙中碳为阳极,发生氧化反应;
②电解NaCl溶液生成NaOH、氢气、氯气;
③氯气具有强氧化性,能将碘离子氧化生成碘单质,碘遇淀粉试液变蓝色;
(2)①甲为原电池,Fe为负极,发生Fe+CuSO4═FeSO4+Cu,
②电解NaCl溶液生成NaOH、氢气、氯气;
③乙为电解池,由电子流向可知,Fe为阴极,铜离子得到电子生成Cu,阳极上氢氧根离子放电,据电极反应式计算.
解答 解:(1)①甲中碳为正极,正极上氧气得电子发生还原反应,电极反应为2H2O+O2+4e-═4OH-,故答案为:2H2O+O2+4e-═4OH-;
②电解NaCl溶液生成NaOH、氢气、氯气,离子反应为2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-,乙中碳为阳极,发生氧化反应,故答案为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-;氧化反应;
③碳电极为阳极,阳极上生成氯气,氯气和碘离子发生置换反应生成碘,碘遇淀粉试液变蓝色,故答案为:在乙装置碳棒电极上生成Cl2,Cl2与I-反应生成I2,I2遇淀粉变蓝;
(2)①甲为原电池,Fe为负极,发生Fe+CuSO4═FeSO4+Cu,所以碳电极上生成红色物质Cu,故答案为:碳;
②电解NaCl溶液生成NaOH、氢气、氯气,化学反应为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2NaOH,故答案为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2NaOH;
③Fe为阴极,铜离子得到电子生成Cu,生成1.6gCu,转移电子物质的量为,$\frac{1.6g}{64g/mol}×2$=0.05mol,生成Cu0.025mol,要使电解后溶液恢复到电解前的状态,则需加入氧化铜粉末的物质的量为0.025mol,质量为0.025mol×80g/mol=2g;乙中阳极上氢氧根离子放电,电极反应为4OH--4e-=O2↑+2H2O,转移0.5mol电子,消耗0.05mol氢氧根离子,生成0.05mol氢离子,氢离子浓度为0.1mol/L,pH为1,故答案为:1;2.
点评 本题考查了原电池和电解池原理,明确电极的判断及各个电极上发生的反应是解本题关键,难点是电极反应式的书写,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,1molN2和3molH2充分反应,生成物中的N-H键数目为6NA | |
| B. | 9.2g 由NO2和N2O4组成的混合物中含有氧原子的数目为 0.2NA | |
| C. | 完全燃烧1.5molCH3CH2OH和C2H4的混合物,转移电子数为18NA | |
| D. | 1L 0.1 mol•L-l的Na2S溶液中S2-和HS-的总数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
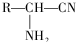 ,R-CN$\stackrel{H+}{→}$RCOOH
,R-CN$\stackrel{H+}{→}$RCOOH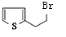 ,在一定条件下Y与BrCl(一氯化溴,与卤素单质性质相似)按物质的量1:1发生加成反应,生成的产物可能有6种.
,在一定条件下Y与BrCl(一氯化溴,与卤素单质性质相似)按物质的量1:1发生加成反应,生成的产物可能有6种. .
.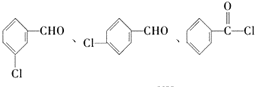 (不考虑立体异构).
(不考虑立体异构).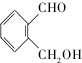 为有机原料制备化合物
为有机原料制备化合物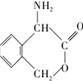 的合成路线流程图(无机试剂任选).
的合成路线流程图(无机试剂任选).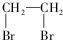 )
)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合物XW中含有共价键 | |
| B. | 化合物ZW中含有离子键 | |
| C. | X和Z可以形成离子化合物ZX | |
| D. | 化合物ZYX和ZYW所含有的键型不一样 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
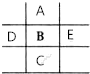 如图是元素周期表的一部分,已知A、B、C、D、E5种原子核外共有85个电子,其中只有C元素原子次外层电子数为18,则B元素是( )
如图是元素周期表的一部分,已知A、B、C、D、E5种原子核外共有85个电子,其中只有C元素原子次外层电子数为18,则B元素是( )| A. | 铝 | B. | 镁 | C. | 磷 | D. | 硫 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
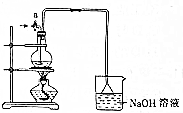 某化学探究小组为探究能与碳反应的浓硫酸的最低浓度,设计了如图实验装置进行实验.
某化学探究小组为探究能与碳反应的浓硫酸的最低浓度,设计了如图实验装置进行实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 加入 试剂 | 稀硫酸 | 浓硫酸、加热 | 稀硝酸 | 浓硝酸 |
| 实验 现象 | 红色固体和 蓝色溶液 | 无色气体 | 无色气体和 蓝色溶液 | 红棕色气体 和蓝色溶液 |
| A. | Cu | B. | Cu2O | ||
| C. | 一定有Cu2O,可能有Cu | D. | 一定有Cu,可能有Cu2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com