
以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
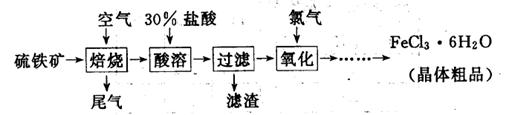
(1)氧化过程中发生反应的离子方程式是 ,检验氧化生成的阳离子的试剂是 。
(2)尾气中主要含N2、O2、SO2和少量的CO2、H2O,取标准状况下的尾气V L测定SO2含量:
方案一:让尾气缓慢通过以下装置。
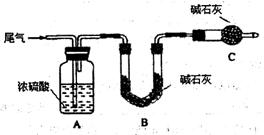
①C仪器的名称是 ,该装置的作用是 。
②实验时先通入尾气,再通入一定量氮气。若通过B装置的增重来测量SO2的体积分数。你认为该方案是否合理 ,请说明理由 (若方案合理该空不必填写)。
方案二:将尾气缓慢通过足量溴水,在所得的溶液中加入过量氯化钡溶液后,过滤,将沉淀洗涤、干燥,称得其质量为m g。
①加入过量氯化钡溶液的目的是 。
②进行沉淀洗涤的方法是 。
③SO2含量的表达式是 (用含m、V的代数式表示)。
(3)从FeCl3溶液中得到FeCl3 6H2O晶体的操作包括 、冷却结晶、过滤,该过程需保持盐酸过量,结合必要的离子方程式说明原因 .
6H2O晶体的操作包括 、冷却结晶、过滤,该过程需保持盐酸过量,结合必要的离子方程式说明原因 .
科目:高中化学 来源: 题型:
【化学—化学与技术】
I.目前,我国采用“接触法”制硫酸,设备如图所示:
 (1)图中设备A的名称是_____________ ,该设备中主要反应的化学方程式为 。
(1)图中设备A的名称是_____________ ,该设备中主要反应的化学方程式为 。
(2)有关接触法制硫酸的下列说法中,不正确的是_______(填字
母序号)。
A.二氧化硫的接触氧化在接触室中发生
B.吸收塔用浓度为98.3%浓硫酸吸收三氧化硫
C.煅烧含硫48%的黄铁矿时,若FeS2损失了2%,则S损失2%
D.B装置中反应的条件之一为较高温度是为了提高SO2的转化率
E.硫酸工业中在接触室安装热交换器是为了利用SO3转化为 H2SO4时放出的热量
II. 纯碱是一种重要的化工原料。制碱工业主要有“氨碱法”(索尔维法)和“联合制碱法”(侯氏制碱法)两种工艺。请按要求回答问题:
(3)CO2是制碱工业的重要原料,“联合制碱法”中CO2的来源于 ,“氨碱法”中CO2来源
于 。
(4)氨碱法的原子利用率(原子利用率=期望产物的总质量与生成物的总质量之比) 。
(5)写出“联合制碱法”有关反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是某研究性学习小组设计制取氯气并以氯气为反应物进行特定反应的装置。

(1)要将C装置接入B和D之间,正确的接法是a→______→________→d。
(2)实验开始先点燃A处的酒精灯,打开活塞K,让Cl2充满整个装置,再点燃D处的酒精灯。Cl2通过C装置后进入D,D装置内盛有炭粉,发生氧化还原反应,生成CO2和HCl(g),发生反应的化学方程式为__________________________________________。
为了使C装置发挥更好的作用,可向烧杯中加入浓硫酸,加入浓硫酸的作用是________________________________________________________________________
________________________________________________________________________。
(3)D处反应完毕后,关闭弹簧夹K,移去两个酒精灯,由于余热的作用,A处仍有少量Cl2产生,此时B中的现象是
________________________________________________________________________,
B的作用是___________________________________________________________。
(4)在A、B、C、D、E装置中有一处需要改进,说明需要改进的理由并在方框中画出改进后的装置图。

查看答案和解析>>
科目:高中化学 来源: 题型:
利用实验器材(规格和数量不限)能完成相应实验的一项是
| 选项 | 实验器材(省略夹持装置) | 相应实验 l |
| A | 三脚架、泥三角、坩埚、坩埚钳 | 用CuSO4 |
| B | 烧杯、玻璃棒、胶头滴管、容量瓶 | 用浓盐酸配制0.1mol·L-1的HCl溶液 |
| C | 烧杯、玻璃棒、胶头滴管、分液漏斗 | 用饱和Na2CO3溶液除去乙酸乙酯中的乙酸和乙醇 |
| D | 烧杯、酸式滴定管、碱式滴定管 | 用H2SO4标准液滴定未知浓度的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
对于:2C4H10(g) + 13O2(g) = 8CO2(g) + 10H2O(l) △H=-5800kJ/mol 叙述错误的是( )
A.该反应的反应热为△H= -5800kJ/mol,是放热反应。
B.该反应的△H与各物质的状态有关,与化学计量数也有关。
C.该式的含义为:25℃、101kPa,2mol C4H10气体完全燃烧生成CO2和液态水时放出热量5800kJ。
D.由该反应的热化学方程式可知丁烷的燃烧热为5800kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
分子式C4H8O2的有机物与硫酸溶液共热可得有机物A和B。将A氧化最终可得C,且B和C为同系物。若C可发生银镜反应,则原有机物的结构简式为
A.HCOOCH2CH2CH3 B.CH3COOCH2CH3
C.CH3CH2COOCH3 D.HCOOCH(CH3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学小组在实验室模拟用软锰矿(主要成分MnO2,杂质为铁及铜的化合物等)制备高纯碳酸锰,过程如下(部分操作和条件略):
① 缓慢向烧瓶中通入过量混合气进行“浸锰”操作,主要反应原理为:
SO2+ H2O = H2SO3 ; MnO2+ H2SO3 = MnSO4+ H2O
(铁浸出后,过量的SO2 会将Fe3+还原为Fe2+)
② 向“浸锰”结束后的烧瓶中加入一定量纯MnO2粉末。
③ 再用Na2CO3溶液调节pH为3.5左右,过滤。
④ 调节滤液pH为6.5~7.2 ,加入NH4HCO3 ,有浅红色的沉淀生成,过滤、洗涤、干燥,得到高纯碳酸锰。回答下例问题:
(1)步骤②中加入一定量纯MnO2粉末的主要作用是将Fe2+氧化为Fe3+ ,将过量的SO2氧化除去,相应反应的离子方程式为 。
(2)查阅表1,步骤③中调pH为3.5时沉淀的主要成分是 。
表1:生成相应氢氧化物的pH
| 物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 8.3 | 4.7 |
| 完全沉淀pH | 3.7 | 9.6 | 9.8 | 6.7 |
(3)步骤③中所得的滤液中含有Cu2+,可添加过量的难溶电解质MnS除去Cu2+,经过滤,得到纯净的MnSO4。用平衡移动原理解释加入MnS的作用_________________。
(4)④中加入NH4HCO3 后发生反应的离子方程式是____________________。
(5)检验④中沉淀是否洗涤干净的方法是 。
(6)现有常温下的四种溶液:
①0.1mol·L-1 NH4Cl溶液
②0.1mol·L-1 NH4Cl和0.1mol·L-1 NH3·H2O的混合溶液(显碱性)
③0.1mol·L-1 NH3·H2O
④0.1mol·L-1 NH4Cl和0.1mol·L-1 HCl
下例说法正确的有 (填字母序号)
A. NH4+离子浓度从大到小的顺序为②>④>①>③
B.溶液的pH从大到小的顺序为③>①>②>④
C.溶液中的离子总浓度从大到小的顺序为④>①>②>③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com