
【题目】某温度时,在2L容器中X、Y、Z三种物质的量随时间的变化曲线如图所示.由图中数据分析. 
(1)达到平衡时,Y的浓度为
(2)反应开始至2min,Z的平均反应速率为
(3)该反应的化学方程式为 .
【答案】
(1)0.35mol/L
(2)0.05mol/(L.min)
(3)X+3Y?2Z
【解析】解:(1)由物质的量随时间的变化曲线图可知,平衡时Y的物质的量为0.7mol,则c= ![]() =
= ![]() =0.35mol/L,
=0.35mol/L,
所以答案是:0.35mol/L;
(2.)反应开始至2min,Z的物质的量增多0.2mol,则v= ![]() =
= ![]() =0.05mol/(L.min),
=0.05mol/(L.min),
所以答案是:0.05mol/(L.min);
(3.)由图可知,2min内X、Y的物质的量减少,Z的物质的量增加,则X、Y为反应物,Z为生成物,X、Y、Z的物质的量变化量之比为(1﹣0.9):(1﹣0.7):(0.2﹣0)=1:3:2,
由物质的量的变化量之比等于化学计量数之比,且2min时达到化学平衡,则化学反应方程式为X+3Y2Z,所以答案是:X+3Y2Z.
【考点精析】通过灵活运用化学平衡的计算,掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%即可以解答此题.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应式为__________、_______。
(2)用甲烷制取氢气的两步反应的能量变化如下图所示:

甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是________________。
(3)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=-159.5KJ/mol
②NH2CO2NH4(s)= CO(NH2)2(s) +H2O(g) △H=+116.5KJ/mol
③H2O(l)=H2O(g) △H=+44KJ/mol
写出CO2与NH3合成尿素和液态水的热化学方程式__________________。
(4)氨气在纯氧中燃烧,生成一种单质和水。科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极在碱性条件下发生反应的电极反应式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如图变化: 
一个B分子中含有的Z原子个数比C分子中少1个,B、C两种分子中的电子数均等于10.请回答下列问题:
(1)X元素在周期表中的位置 .
(2)X、Y、Z三种元素可组成一种强酸W,金属铜与W的浓溶液反应,写出该化学方程式 , W体现了的性质(填序号).
a.氧化性 b.还原性 c.酸性
(3)将A与X的混合气体通入水中,恰好完全反应生成强酸W,写出该化学方程式
(4)探究实验发现,强酸W发生氧化还原反应时,浓度越稀,对应还原产物中元素化合价越低.在一定条件下,少量的镁与足量极稀的W充分反应,生成还原产物的化合价最低,若生成的还原产物为0.1mol,则参加反应的W为mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生设计氨催化氧化实验,并将制得NO进一步氧化为NO2用水吸收NO2 , 并检验HNO3的生成.
可供选择的固体药品有:NH4Cl、Ca(OH)2、KClO3、MnO2、CaO
可供选择的液体药品有:浓氨水、过氧化氢、浓盐酸、水
可供选择的仪器有:如图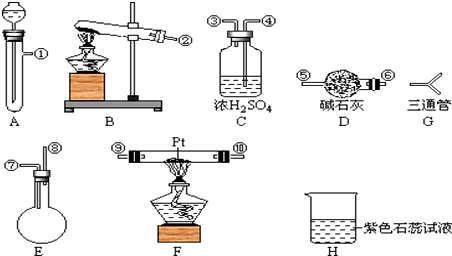
另有铁架台、铁夹、铁圈、乳胶管若干,可供选择.设计实验时,A和B两个制气装置允许使用两次,其余装置只能使用一次.
(1)氨氧化制NO的化学方程式为 , 该反应应在装置中进行.
(2)为快速制O2和NH3 , 制取O2化学方程式为;制取NH3化学反应方程式为
(3)利用快速制NH3和O2的装置组装,各仪器按气流方向连接的正确顺序为(按装置先后顺序排列)![]()
(4)装置C的作用是 .
(5)装置H中溶液变红,其原因是(用化学方程式表示) .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将锌,铜通过导线相连,置于稀硫酸中构成原电池,完成下空 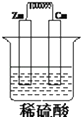
(1)锌为:极(填“正”或“负”)电极反应式为: ,
(2)反应过程中电流的方向为:
A 由铜流向锌 B 由锌流向铜
(3)若有锌片质量减少了0.65g,则转移了mol电子发生转移,铜片上产生气体的体积(标况下)为:L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热化学方程式中的ΔH实际上是热力学中的一个物理量,叫做焓变,其数值和符号与反应物和生成物的总能量有关,也与反应物和生成物的键能有关。
(1)已知反应CH3—CH3(g) → CH2=CH2(g)+H2(g),有关化学键键能如下。
化学键 | C—H | C=C | C—C | H—H |
键能/kJ·mol-1 | 414.4 | 615.3 | 347.4 | 435.3 |
试计算该反应的反应热___________________________
(2)已知H2(g)+Br2(l)=2HBr(g);ΔH=-72 kJ/mol。蒸发1 mol Br2(l)需要吸收的能量为30 kJ,其它相关数据如下表:
H2(g) | Br2(g) | HBr(g) | |
1 mol分子中的化学键断裂时需要吸收的能量(kJ) | 436 | a | 369 |
则表中a为__________
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行理论推算。试依据下列热化学方程式,计算反应
2C(s)+2H2(g)+O2(g)=CH3COOH(l)的焓变ΔH=________。
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1=-870.3 kJ·mol-1
②C(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ·mol-1
③H2(g)+1/2O2(g)=H2O(l) ΔH3=-285.8 kJ·mol-1
(4)如下图Ⅰ所示表示的是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:___________________________________________________________________。
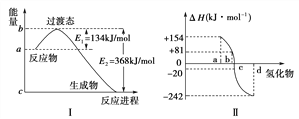
(5)图Ⅱ表示氧族元素中的氧、硫、硒(Se)、碲(Te)在生成氢化物时的焓变数据,根据焓变数据可确定a、b、c、d分别代表哪种元素,试写出硒化氢发生分解反应的热化学方程式:_____________________。
(6)已知:
①Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g);ΔH=-25 kJ·mol-1,
②3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g);ΔH=-47 kJ·mol-1,
③Fe3O4(s)+CO(g)===3FeO(s)+CO2(g);ΔH=+19 kJ·mol-1
请写出CO还原FeO的热化学方程式:__________________________。
(7) 火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。热化学方程式为:N2H4(l) + 2H2O2(l) == N2(g) + 4 H2O(g) △ H=-644.25 kJ/molspan>。又已知H2O (l) == H2O (g) ΔH=+ 44 kJ/mol。则64g液态肼
与液态双氧水反应生成液态水时放出的热量是 _________________ kJ。
(8)焙烧产生的SO2可用于制硫酸。已知25 ℃、101 kPa时:
2SO2(g)+O2(g)![]() 2SO3(g) ΔH1=-197 kJ·mol-1;
2SO3(g) ΔH1=-197 kJ·mol-1;
H2O(g)===H2O(l) ΔH2=-44 kJ·mol-1;
2SO2(g)+O2(g)+2H2O(g)===2H2SO4(l) ΔH3=-545 kJ·mol-1。
则SO3(g)与H2O(l)反应的热化学方程式是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.Fe在氯气中燃烧生成FeCl2
B.电解氯化钠溶液制取金属单质钠
C.将AlCl3溶液逐滴滴入到NaOH溶液,先产生白色沉淀,最后沉淀消失
D.常温下,铝制品用浓硫酸或浓硝酸处理过,可耐腐蚀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com