
科目:高中化学 来源:2016届山东省高三上学期开学考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.甲醛、氯乙烯和乙二醇均可作为合成聚合物的单体
B.麦芽糖与蔗糖的水解产物均含葡萄糖,故二者均为还原性二糖
C.若两种二肽互为同分异构体,则二者的水解产物一定不同
D.天然植物油常温下一般呈液态,难溶于水,有恒定的熔点、沸点
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽省合肥市高二上开学考试化学试卷(解析版) 题型:实验题
(14分)某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
分组实验 | 催化剂 | |
① | 10mL 5% H2O2溶液 | 无 |
② | 10mL 2% H2O2溶液 | 无 |
③ | 10mL 5% H2O2溶液 | 1mL 0.1mol•L﹣1FeCl3溶液 |
④ | 10mL 5%H2O2溶液+少量HCl溶液 | 1mL 0.1mol•L﹣1FeCl3溶液 |
⑤ | 10mL 5% H2O2溶液+少量NaOH溶液 | 1mL 0.1mol•L﹣1FeCl3溶液 |
(1)写出实验③中H2O2分解反应方程式并标明电子转移的方向和数目: .
(2)实验①和②的目的是 .
实验时由于没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进是 .
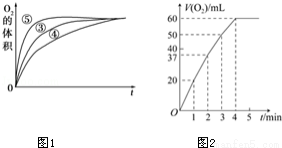
(3)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图1.分析上图能够得出的实验结论: 环境能增大H2O2分解的速率; 环境能减小H2O2分解速率.
(4)将0.1g MnO2粉末加入50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图2所示.解释反应速率变化的原因: ,计算H2O2的初始物质的量浓度为 .(保留两位有效数字,在标准状况下测定)
查看答案和解析>>
科目:高中化学 来源:2016届湖北省高三普通班8月月考化学试卷(解析版) 题型:选择题
某同学设计如下图所示装置,探究氯碱工业原理,下列说法正确的是

A.石墨电极与直流电源负极相连
B.用湿润KI淀粉试剂在铜电极附近检验气体,试纸变蓝色
C.氢氧化钠在石墨电极附近产生, Na+向石墨电极迁移
D.铜电极的反应式为:2H+ + 2e-= H2↑
查看答案和解析>>
科目:高中化学 来源:2016届江西省高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列实验操作正确的是
A.把没用完的药品倒回原试剂瓶中保存
B.配制稀硫酸时,先在量筒内放好水,再缓缓地加入一定量的浓硫酸
C.用天平称量药品质量时,先加质量大的砝码,再加质量小的砝码
D.用排水取气法收集气体时,导管应插入试管底部
查看答案和解析>>
科目:高中化学 来源:2016届湖北省高三9月调考化学试卷(解析版) 题型:选择题
下列说法错误的是
A.向0.1 mol/L的CH3COOH溶液中加入少量CH3COONH4固体,溶液的pH增大
B.室温下,pH=4的NaHSO4溶液中,水电离出的H+浓度为1×10-10 mol/L
C.浓度均为0.1 mol/L的HCN溶液和NaCN溶液等体积混合(忽略体积变化),溶液中c(HCN)+c(CN-)=0.1 mol/L
D.pH相同的①NH4Cl、②NH4Al(SO4)2、③(NH4)2SO4三种溶液的c(NH4+):②<③<①
查看答案和解析>>
科目:高中化学 来源:2016届贵州省高三第一次模拟化学试卷(解析版) 题型:选择题
下图是另一种元素周期表——三角形元素周期表的一部分,图中标示了L、M、Q、R、T元素的位置,下列判断正确的是

A.Q、T两元素的氢化物的稳定性为HnT<HnQ
B.L、R的单质与盐酸反应速率为R>L
C.M与T形成的化合物有两性
D.L、Q形成的简单离子核外电子数相等
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省大连市高三期初考试化学试卷(解析版) 题型:选择题
1mol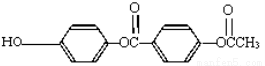 与足量的NaOH
与足量的NaOH

 溶液充分反应,消耗NaOH的物质的量为
溶液充分反应,消耗NaOH的物质的量为
 A.5 mol B.4 mol C.3 mol D.2 mol
A.5 mol B.4 mol C.3 mol D.2 mol
查看答案和解析>>
科目:高中化学 来源:2016届甘肃省平凉市高三上学期第一次模拟考试化学试卷(解析版) 题型:选择题
“物质的量”是联系宏观世界和微观世界的桥梁。下列说法正确的是( )
A.“摩尔”是“物质的量”的单位
B.1 mol O2的质量是32 g/mol
C.任何气体的“气体摩尔体积”均为22.4 L/mol
D.10 mL 2 mol/L H2SO4溶液中取出的5 mL溶液,其浓度为1 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com