
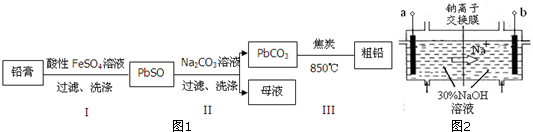
���� ��1��Ǧ�ࣨ��Ҫ�ɷ�ΪPbO��PbO2��PbSO4���������ķ�ӦΪPbO2+2Fe2++SO42-+4H+�TPbSO4+2Fe3++2H2O��
��2��������I��ַ�Ӧ��δ���ˡ�ϴ�ӣ���Һ�е�H+��Fe3+����CO32-��Ӧ���ᵼ�²���II��Na2CO3���������ӣ�
��3����ΪKsp��PbSO4��=1.6��10-5��Ksp ��PbCO3��=3.3��10-14��c��SO42-��=1.6mol•L-1��c��CO32-��=3.3��10-6mol•L-1��PbCO3�У�c��Pb2+��=$\frac{Ksp��PbC{O}_{3}��}{c��C{{O}_{3}}^{2-}��}$=$\frac{3.3��1{0}^{-14}}{3.3��1{0}^{-6}}$=1.0��10-8mol•L-1��PbSO4�У�Q=c��Pb2+����c��SO42-��=1.0��10-8��1.6=1.6��10-8��Ksp��PbSO4����˵��PbSO4��ĸҺ��δ���ͣ���PbCO3�в�����PbSO4��
��4������ͬ�����ͬŨ�ȵ�NaHCO3��Һ����Na2CO3��Һ������Na2CO3��Һ��c��CO32-���ϴ�NaHCO3��Һ��c��CO32-����С��ʹ��PbSO4ת���ʱ�С��
��5��PbCO3�ͽ�̿�����ʵ�����2��1Ͷ�ϣ���ӦΪ2PbCO3+C=2Pb+3CO2��
��6���ٸ����������������ƶ�֪��aΪ���������Դ����������
�ڵ������У�HPbO2-�������õ��ӣ��缫��ӦʽΪHPbO2-+2e-+H2O�TPb+3OH-��
�������ӽ���Ĥֻ����������ͨ������ֹHPbO2-���������ұ��������Ӷ����PbԪ�ص������ʣ�
��� �⣺��1��Ǧ�ࣨ��Ҫ�ɷ�ΪPbO��PbO2��PbSO4���м�����������������Һ�������ķ�ӦΪPbO2+2Fe2++SO42-+4H+�TPbSO4+2Fe3++2H2O���ʴ�Ϊ��PbO2+2Fe2++SO42-+4H+�TPbSO4+2Fe3++2H2O��
��2��������I��ַ�Ӧ��δ���ˡ�ϴ�ӣ���Һ�е�H+��Fe3+����CO32-��Ӧ���ᵼ�²���II��Na2CO3���������ӣ��ʴ�Ϊ����Һ�е�H+��Fe3+����CO32-��Ӧ��
��3����ΪKsp��PbSO4��=1.6��10-5��Ksp ��PbCO3��=3.3��10-14��c��SO42-��=1.6mol•L-1��c��CO32-��=3.3��10-6mol•L-1��PbCO3�У�c��Pb2+��=$\frac{Ksp��PbC{O}_{3}��}{c��C{{O}_{3}}^{2-}��}$=$\frac{3.3��1{0}^{-14}}{3.3��1{0}^{-6}}$=1.0��10-8mol•L-1��PbSO4�У�Q=c��Pb2+����c��SO42-��=1.0��10-8��1.6=1.6��10-8��Ksp��PbSO4����˵��PbSO4��ĸҺ��δ���ͣ���PbCO3�в�����PbSO4���ʴ�Ϊ��PbCO3��c��Pb2+��=$\frac{3.3��1{0}^{-14}}{3.3��1{0}^{-6}}$=1.0��10-8mol•L-1��PbSO4��Q=c��Pb2+����c��SO42-��=1.0��10-8��1.6=1.6��10-8��Ksp��PbSO4����˵��PbSO4��ĸҺ��δ���ͣ���PbCO3�в�����PbSO4��
��4������ͬ�����ͬŨ�ȵ�NaHCO3��Һ����Na2CO3��Һ������Na2CO3��Һ��c��CO32-���ϴ�NaHCO3��Һ��c��CO32-����С��ʹ��PbSO4ת���ʱ�С���ʴ�Ϊ��PbSO4ת���ʱ�С����������ͬŨ�ȵ�Na2CO3��NaHCO3��Һ�У�ǰ��c��CO32-���ϴ�
��5��PbCO3�ͽ�̿�����ʵ�����2��1Ͷ�ϣ���ӦΪ2PbCO3+C=2Pb+3CO2���ʴ�Ϊ��CO2��
��6���ٸ����������������ƶ�֪��aΪ���������Դ�����������ʴ�Ϊ������
�ڵ������У�HPbO2-�������ŵ磬����HPbO2-�ŵ�ĵ缫��ӦʽΪHPbO2-+2e-+H2O�TPb+3OH-���ʴ�Ϊ��HPbO2-+2e-+H2O�TPb+3OH-��
�������ӽ���Ĥֻ����������ͨ������ֹHPbO2-���������ұ��������Ӷ����PbԪ�ص������ʣ��ʴ�Ϊ�������ӽ���Ĥ��ֹHPbO2-���������ұ�������
���� �����Դ�Ǧ�ࣨ��Ҫ�ɷ�ΪPbO��PbO2��PbSO4������ȡǦ��Ϊ����������δ֪��Ӧ��д���ܶȻ����绯ѧ������ʵ�����⣬����չʾ���û�ѧ֪ʶ������������е�ʵ�����⣬�����˻�ѧ�뻷������ѧ������Ĺ�ϵ������������ע�뻯ѧ�йصĿ�ѧ��������̬�����Ŀɳ�����չ��


 �����������ҵ�������������ϵ�д�
�����������ҵ�������������ϵ�д� ѧ���������ν��Ͼ���ѧ������ϵ�д�
ѧ���������ν��Ͼ���ѧ������ϵ�д� Happy holiday���ּ��������ҵ�㶫���������ϵ�д�
Happy holiday���ּ��������ҵ�㶫���������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���� | B�� | ���� | C�� | ������ | D�� | ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
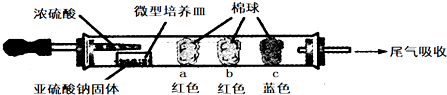
| ���� | �����ϵμӵ��Լ� | ʵ������ | ���ͺͽ��� |
| a | Ʒ����Һ | �����ף��Ⱥ��ָֻ���ɫ | |
| b | ����̪��NaOH��Һ | �����Ϊ��ɫ | ���ӷ���ʽ�� 2OH��+SO2=SO32��+H2O ��OH��+SO2=HSO3�� |
| c | �����۵ĵ�ˮ | �����Ϊ��ɫ | ���ۣ���������л�ԭ �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2�� | B�� | 3�� | C�� | 4 | D�� | 5�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1molCO��g����ȫȼ������CO2��g���ų�����283J | |
| B�� | 1molCO��g����ȫȼ�ձ�1molC��s����ȫȼ�շų��������� | |
| C�� | 2Na2O2��s��+2CO2��s��=2Na2CO3��s��+O2 ��g����H��-452kJ/mol | |
| D�� | ��Na2O2��s����CO2��g����Ӧ����Na2CO3��s����O2 ��g���ų�452kJ����ʱ��ת�Ƶĵ�����Ϊ2mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | PbCO3 | B�� | 2PbCO3•Pb��OH��2 | C�� | Pb��OH��2 | D�� | ��CH3COO��2Pb |
�鿴�𰸺ͽ���>>
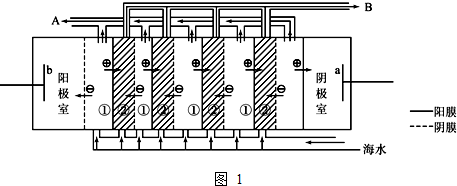
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com