
【题目】常温下,将浓度均为0.10mol.L﹣1、体积均为V0L的HX溶液和HY溶液分别加水稀释至体积为VL,其AG[AG=lg ![]() ]随lg
]随lg ![]() 的变化如图所示,下列叙述错误的是( )
的变化如图所示,下列叙述错误的是( ) 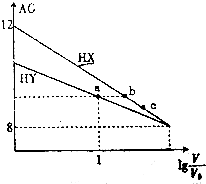
A.HX的酸性强于HY的酸性
B.a点的c(Y﹣)与b点的c(X﹣)相等
C.水的电离程度:a点小于c点
D.若两溶液同时升高温度,则c(Y﹣)和c(X﹣)均增大
【答案】D
【解析】解:A.相同浓度时,AG的值越大,溶液中氢离子浓度越大,稀释前HX的溶液中AG的值大,即HX溶液中氢离子浓度大,所以HX的酸性比HY强,故A正确;B.a、b两点的AG值相同,即氢离子浓度相同,则两个溶液中氢氧根离子的浓度也相同,所以c(Y﹣)的c(X﹣)相同,即a点的c(Y﹣)与b点的c(X﹣)相等,故B正确;
C.AG的值越大,溶液中氢离子浓度越大,对水的电离的抑制程度越大,a点的AG值大,a点溶液中氢离子浓度大,水的电离程度小,所以水的电离程度:a点小于c点,故C正确;
D.稀释前,HX的溶液中AG=12,说明c(H+)=0.1mol/L,而酸的浓度为0.1mol/L,所以HX为强酸,在溶液中完全电离,升高温度,溶液中c(X﹣)不变,故D错误.
故选D.
【考点精析】利用弱电解质在水溶液中的电离平衡对题目进行判断即可得到答案,需要熟知当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】利用自然资源制备相关化学物质,下列化工生产不可行的是( )
A.FeS2 ![]() SO2
SO2 ![]() H2SO3
H2SO3 ![]() H2SO4
H2SO4
B.石英砂 ![]() 粗硅
粗硅 ![]() 粗SiCl4
粗SiCl4 ![]() 高纯硅
高纯硅
C.提取食盐后的母液 ![]() 含Br2的液体
含Br2的液体 ![]()
![]() 粗Br2
粗Br2 ![]() Br2
Br2
D.铝土矿 ![]() NaAlO2(aq)
NaAlO2(aq) ![]() Al(OH)3
Al(OH)3 ![]() Al2O3
Al2O3 ![]() Al
Al
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
A. 试管、烧杯均可用于给液体、固体加热
B. 使食盐水中NaCl结晶析出时,用到的仪器有坩埚、酒精灯、玻璃棒、泥三角
C. 区别NaCl、Na2SO4时常用到胶头滴管、试管
D. 漏斗可用于过滤及向滴定管中添加溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物是药物生产的中间体,其结构简式如图.下列有关叙述正确的是( ) 
A.该有机物能与溴水发生加成反应
B.该有机物与浓硫酸混合加热可发生消去反应
C.1mol该有机物与足量NaOH溶液反应最多消耗3mol NaOH
D.该有机物经催化氧化后能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由锌、铁、铝、镁四种金属中的两种组成的混合物23g,与足量的盐酸反应产生的氢气标准状况下为22.4L,则两种金属组成的混合物可能是( )
A.锌与镁
B.铁与锌
C.铝与铁
D.镁与铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作正确的是
A.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
B.萃取操作时,应选择溶质在其中更易溶的溶剂作萃取剂,且萃取剂与原溶剂互不相溶,其密度比原溶剂的可以大也可以小
C.用玻璃棒搅拌漏斗中的液体以加快过滤的速度
D.加入盐酸以除去硫酸钠中的少量碳酸钠杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有aXn+和bYm-两种元素的简单离子,若它们的电子层结构相同,则下列关系正确的是
A. b-a=n+m
B. a-b=n-m
C. 核电荷数Y<X
D. 原子半径Y>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下面两种方祛可以制得白色的Fe(OH)2沉淀. 方法一:用不含Fe3+的FeSO4溶液与不含O2的蒸馏水配制的NaOH溶液反应制备.
(1)制取所需的FeSO4溶液需要的反应物为 .
(2)生成白色Fe(OH)2沉淀的操作是用长滴管吸取NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液.这样操作的理由是 .
(3)方法二:在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备. 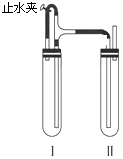
在试管Ⅰ里加入的试剂是 .
(4)在试管Ⅱ里加入的试剂是 . 操作:先打开止水夹,使I管中反应一段时间后再夹紧止水夹,实验中观察到I管中溶液被压入II管中,II中发生反应的离子方程式为: .
(5)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X+的核外电子数分别为2、8、8,则X元素在周期表中的位置是( )
A. 第三周期第0族 B. 第四周期第ⅠA族
C. 第三周期第ⅠA族 D. 第三周期第ⅦA族
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com