
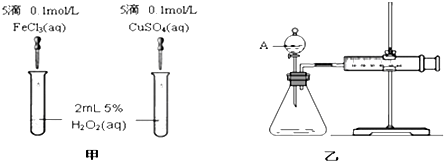
分析 (1)①根据H2O2分解的催化作用有可能是氯离子起的作用解答即可;
②根据乙图装置来选择气密性的检查方法,该反应是通过反应速率分析的,所以根据v=$\frac{△c}{△t}$来判断;
(2)①此反应的反应物为酸性高锰酸钾和草酸溶液,生成物突然无色,说明生成锰离子,依据氧化还原反应原理书写化学反应方程式即可;
②锰离子有催化作用;③要想验证锰离子的催化作用,再加入硫酸锰即可;
(3)根据KI、Na2S2O3与淀粉的反应原理解答.
解答 解:(1)①由于两种催化剂的阴离子与阳离子均不同,故阴离子也可能对双氧水的分解起到催化作用,故答案为:否;两催化剂的阴离子不同;
②结合乙图装置,该气密性的检查方法为:关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,如活塞复原,则装置的气密性良好;反应是通过反应速率分析的,根据v=$\frac{△c}{△t}$,所以,实验中需要测量的数据产生40ml气体所需的反应时间,
故答案为:关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,如活塞复原,则装置的气密性良好;产生40ml气体所需的反应时间;
(2)①酸性高锰酸钾和草酸溶液在硫酸酸化条件下生成硫酸锰、硫酸钾等,化学反应方程式为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,
故答案为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑;
②KMnO4与H2C2O4反应生成硫酸锰,锰离子有催化作用,所以猜想还可能是催化剂的作用,故答案为:催化剂;
③要想验证锰离子的催化作用,在做对比实验时同时加入硫酸锰观察反应速率是否变化即可,故选:B;
(3)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,先发生S2O82-+2I-═2SO42-+I2(慢),后发生I2+2S2O32-═S4O62-+2I- (快),当S2O32-耗尽后,碘才能与淀粉作用显示蓝色,用淀粉溶液做指示剂,通过褪色时间判断浓度与反应速率的关系,I2应完全反应,蓝色褪去,采取控制变量法,KI的浓度不变,改变K2S2O8溶液浓度,即采取①④⑤或②④⑤,S2O82-+2I-═2SO42-+I2 (慢) I2+2S2O32-═2I-+S4O62-(快),当有蓝色出现时,快反应进行完全,
此时只发生反应:S2O82-+2I-═2SO42-+I2 (慢)
1 1
故有I2+2S2O32-═2I-+S4O62-(快),
1 2
c $\frac{4.0mL×0.10mol/L}{4mL+4ml+1mL+1mL}$=0.04,
故△c(I2)=△c(S2O82-)=0.02mol/L,故v(S2O82-)=$\frac{0.02mol/L}{2s}$=0.01mol•L-1•s-1,
故答案为:Na2S2O3;①④⑤或②④⑤;0.01mol•L-1•s-1.
点评 本题考查了实验探究,注意探究外界条件对化学反应影响时,只能改变一个条件,其它条件必须相同,否则不能得出正确结论,难度较大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 使用如图所示装置进行化学小实验,请填写下列空白:
使用如图所示装置进行化学小实验,请填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol | B. | 2mol | C. | 2.5mol | D. | 4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径的大小顺序为:rw>rz>ry | |
| B. | 元素W的氧化物对应水化物的酸性比Y的强 | |
| C. | X与Y形成的晶体XaYa的熔点高硬度大,为可替代金刚石的材料 | |
| D. | X与W形成的化合物和Z与W形成的化合物的化学类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 高铁酸钾(K2FeO4)是一种绿色氧化剂,在许多领域展现出广阔的应用前景.
高铁酸钾(K2FeO4)是一种绿色氧化剂,在许多领域展现出广阔的应用前景.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 共有7个周期,16个族 | |
| B. | 形成化合物种类最多的元素在第2周期 | |
| C. | 第ⅡA族的右边是第ⅢB族,第ⅢA族的左边是第ⅡB族 | |
| D. | 某主族元素最高价氧化物对应的水化物的化学式为HnROm,其气态氢化物的化学式一定为H2m-nR或RH2m-n |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O和H2O2中的化学键类型完全相同 | |
| B. | N2的结构式为N-N | |
| C. | 一个D216O分子所含的中子数为10 | |
| D. | NaCl的电子式为  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、NO3-、K+、SO42ˉ | B. | Ca2+、H+、CO32ˉ、AlO2- | ||
| C. | OH-、SO42-、NH4+、Ag+ | D. | Fe2+、Mg2+、H+、NO3ˉ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com