
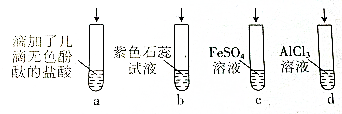
| A. | 若滴加过量的浓氨水,试管a中溶液由无色变红色 | |
| B. | 试管b中溶液由紫色变为蓝色 | |
| C. | 试管c中先有白色沉淀,后变为灰绿色,然后变为红褐色 | |
| D. | 试管d中先有白色沉淀,后白色沉淀消失 |
分析 A.酚酞在碱性溶液中呈红色,在酸性溶液中呈无色,一水合氨为碱能够与盐酸发生酸性中和反应;
B.氨水中含有一水合氨,一水合氨部分电离生成氢氧根离子,溶液显碱性;
C.氨水与硫酸亚铁反应生成氢氧化亚铁,氢氧化亚铁不稳定,继续氧化为氢氧化铁;
D.氢氧化铝只能溶解在强碱中.
解答 解:A.盐酸加酚酞溶液为无色,逐滴滴加氨水直到过量,氨水中的一水合氨为碱能够与盐酸发生酸性中和反应,溶液由酸性变为碱性,所以溶液由无色变红色,故A正确;
B.氨水中含有一水合氨,一水合氨部分电离生成氢氧根离子,溶液显碱性,能够使紫色石蕊变蓝,故B正确;
C.氨水与硫酸亚铁反应生成氢氧化亚铁,氢氧化亚铁不稳定,继续氧化为氢氧化铁,现象为先有白色沉淀,后变为灰绿色,然后变为红褐色,故C正确;
D.氨水中的一水合氨为弱碱,与氯化铝反应生成氢氧化铝沉淀,氢氧化铝不溶于氨水,所以现象产生白色沉淀,沉淀不消失,故D错误;
故选:D.
点评 本题考查了实验现象的判断,明确氨水的成分及性质是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0 | B. | 2.0 | C. | 13.0 | D. | 14.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、HCO3-、NO3- | B. | NH4+、Al3+、SO42-、NO3- | ||
| C. | K+、Fe2+、NH4+、NO3- | D. | NH4+、Na+、NO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
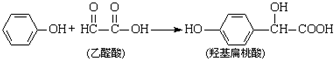
| A. | 该反应是取代反应 | |
| B. | 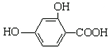 和羟基扁桃酸互为同系物 和羟基扁桃酸互为同系物 | |
| C. | 1个烃基扁桃酸分子中最多有17个原子共平面 | |
| D. | 1mol羟基扁桃酸分子最多能分别和1mol NaHCO3、2mol Na0H、3mol Na、4mol H2发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
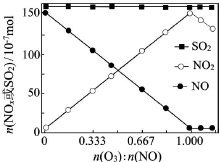 烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量.O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:
烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量.O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-1076.7 kJ/mol | |
| B. | N2H4(g)+$\frac{1}{2}$N2O4(g)═$\frac{3}{2}$N2(g)+2H2O(g)△H=-542.7 kJ/mol | |
| C. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-542.7 kJ/mol | |
| D. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(l)△H=-1059.3 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com