
| A. | 现需80 mL 1.0 mol•L-1 NaOH溶液,称取3.2 g NaOH固体配制溶液浓度偏小 | |
| B. | 装标准液的滴定管未润洗,测得待测液的浓度偏大 | |
| C. | 用pH试纸测得新制氯水的pH为2 | |
| D. | 用酸式滴定管准确量取10.00mLKMnO4溶液 |
分析 A.需80 mL 1.0 mol•L-1 NaOH溶液,配制100mL溶液,结合m=cVM计算;
B.装标准液的滴定管未润洗,消耗标准液偏多;
C.氯水中含HClO,具有漂白性;
D.KMnO4可氧化橡胶.
解答 解:A.需80 mL 1.0 mol•L-1 NaOH溶液,配制100mL溶液,NaOH的质量为0.1L×1.0mol/L×40g/mol=4.0g,则称取3.2 g NaOH固体配制溶液浓度偏小,故A正确;
B.装标准液的滴定管未润洗,消耗标准液偏多,则测得待测液的浓度偏大,故B正确;
C.氯水中含HClO,具有漂白性,则不能使用pH试纸测定,故C错误;
D.KMnO4可氧化橡胶,则用酸式滴定管准确量取10.00mLKMnO4溶液,故D正确;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握配制一定浓度的溶液、中和滴定、实验操作、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:实验题
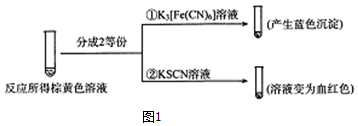
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用灼烧的方法可以区分羊毛和人造纤维 | |
| B. | 医用消毒酒精是体积分数为95%的乙醇 | |
| C. | 食用一定量的油脂能促进人体对某些维生素的吸收 | |
| D. | 加热能杀死流感病毒是因为蛋白质受热变性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4L NO和11.2L O2在密闭容器中充分反应后,总分子数小于NA | |
| B. | 28g C2H4和C3H6的混合物含有C-H键数目为4NA | |
| C. | 标准状况下,22.4L Cl2与适量H2O或NaOH反应转移的电子数目都为NA | |
| D. | 常温下,1L pH=13的Ba(OH)2中OH-的数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石英、水晶、水泥、光导纤维等物质的主要成分是SiO2 | |
| B. | 铁在潮湿的空气中放置,易发生化学腐蚀而生锈 | |
| C. | 医疗上,碳酸氢钠是治疗胃穿孔的一种药剂 | |
| D. | 肥皂水可用作蚊虫叮咬处的清洗剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的化学方程式为:CO2+H2 $?_{高温}^{催化剂}$ CO+H2O | |
| B. | 恒温恒容下,增大压强,H2 浓度一定减小 | |
| C. | 升高温度,逆反应速率减小 | |
| D. | 该反应的反应热为负值 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | ④ | ||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
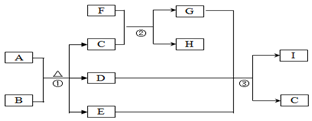 有关物质的转化关系如图所示(部分生成物与反应条件已略去).A是常见的非金属固体单质,F是紫红色的金属单质,B、C是常见的强酸,D、G、I是常见的气体,D与I的组成元素相同,且D的相对分子质量比I的大16.E是最常见的无色液体.
有关物质的转化关系如图所示(部分生成物与反应条件已略去).A是常见的非金属固体单质,F是紫红色的金属单质,B、C是常见的强酸,D、G、I是常见的气体,D与I的组成元素相同,且D的相对分子质量比I的大16.E是最常见的无色液体. .
. 查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H${\;}_{2}^{16}$O、D${\;}_{2}^{16}$O、H${\;}_{2}^{18}$O、D${\;}_{2}^{18}$O互为同位素 | |
| B. | 金刚石、石墨均为碳的同素异形体,其化学性质与物理性质均相似 | |
| C. | 石墨烯(结构如图 所示)是由碳原子构成的单层片状结构的新材料,与石墨互为同位素 所示)是由碳原子构成的单层片状结构的新材料,与石墨互为同位素 | |
| D. | 由于氢原子可以形成H-(如NaH),所以有人建议可将氢元素排在元素周期表的ⅦA族 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com