
| A. | 碳素钢、不锈钢、硬铝、黄铜都属于合金 | |
| B. | 正常雨水的pH为5.6,主要是因为溶解了SO2 | |
| C. | 钢化玻璃常用于制造眼镜片、照相机中的透镜等 | |
| D. | 光化学烟雾主要是由于向大气中任意排放CO2、氟氯烃、SO2等产生的 |
分析 A.合金是指在一种金属中加热熔合其它金属或非金属而形成的具有金属特性的物质;
B.正常雨水中溶解二氧化碳,其pH约为5.6;
C.钢化玻璃的重要用途是制造汽车车窗;
D.碳氢化合物、氮氧化物可导致光化学烟雾.
解答 解:A.碳素钢是铁合金,不锈钢是铁合金,硬铝是铝合金,黄铜是铜锌合金,故A正确;
B.正常雨水中溶解二氧化碳,其pH约为5.6,而溶解二氧化硫的雨水的pH<5.6,属于酸雨,故B错误;
C.钢化玻璃常用于制造汽车车窗,不能制造眼镜片、照相机中的透镜等,故C错误;
D.碳氢化合物、氮氧化物可导致光化学烟雾,对人体有害,应减少排放,故D错误;
故选A.
点评 本题考查物质的组成与用途,常见生活污染物及环境污染,有利于培养学生的良好的科学素养,难度不大,注意相关基础知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | 该元素位于元素周期表的第三周期ⅦA | |
| B. | 该元素位于元素周期表的第二周期VA | |
| C. | 该元素的常见化合价有:-1、0、+1、+3、+5、+7等 | |
| D. | 该元素的氢化物的稳定性比PH3、H2S弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ | |
| B. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | 氢氧化钡溶液与盐酸反应:OH-+H+═H2O | |
| D. | 硫酸铜溶液与氢氧化钡溶液混合:Cu2++2 OH-═Cu(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$ +2NaBr+2H2O.
+2NaBr+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Fe | B. | Mg | C. | Al | D. | Zn |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①在AlCl3溶液中滴加氨水至过量 | |
| B. | ②在盐酸酸化过的AlCl3溶液中滴加氢氧化钠溶液至过量 | |
| C. | ③在AlCl3和FeCl3混合液中滴加氢氧化钠溶液至过量 | |
| D. | ④在FeCl3溶液中滴加氢氧化钠溶液至过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 将一定质量的Mg和Al的混合物投入2.0mol•L-1,250mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图示.则下列说法正确的是( )
将一定质量的Mg和Al的混合物投入2.0mol•L-1,250mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图示.则下列说法正确的是( )| A. | 当加氢氧化钠溶液体积为20mL时,溶液的pH值等于7 | |
| B. | 当加氢氧化钠溶液体积为20mL时,溶液中的溶质只有硫酸镁和硫酸铝 | |
| C. | NaOH溶液的物质的量浓度为5 mol•L-1 | |
| D. | 生成的H2在标准状况下的体积为11.2L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
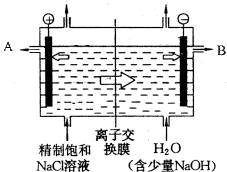 工业上电解制烧碱的技术是用离子交换膜法,主要原料是饱和食盐水.图为离子交换膜法电解原理示意图:
工业上电解制烧碱的技术是用离子交换膜法,主要原料是饱和食盐水.图为离子交换膜法电解原理示意图:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com