
已知:
2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-12CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1
下列说法正确的是
科目:高中化学 来源: 题型:
2H2(g)+O2(g)====2H2O(l);ΔH=-572 kJ·mol-1
若将标准状况下H2和O2混合气体点燃爆炸后,再恢复到原状况时气体体积减少3.36 L,则反应放出的热量为( )
A.24.2 kJ B.25.2 kJ C.27.6 kJ D.28.6 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:2H2(g)+O2(g)![]() 2H2O(g)ΔH=-483.6kJ·mol-1;H2(g)+1/2O2(g)
2H2O(g)ΔH=-483.6kJ·mol-1;H2(g)+1/2O2(g)![]() H2O(l) ΔH=-285.8kJ·mol-1,由此可知,在等温下蒸发45 g液态水需吸收_________kJ的热量。
H2O(l) ΔH=-285.8kJ·mol-1,由此可知,在等温下蒸发45 g液态水需吸收_________kJ的热量。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年吉林省长春二中高二上学期期末考试化学试卷(带解析) 题型:填空题
(10分)工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
CO(g)+H2O(g)  CO2(g)+H2(g) △H=-41 kJ/mol
CO2(g)+H2(g) △H=-41 kJ/mol
某小组研究在相同温度下该反应过程中的能量变化。他们分别在体积均为V L的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应。相关数据如下:
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | ||||
| CO | H2O | CO2 | H2 | ||||
| ① | 1 | 4 | 0 | 0 | t1 | 放出热量:32.8 kJ | |
| ② | 2 | 8 | 0 | 0 | t2 | 放出热量:Q | |
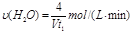
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省广州六中高二上学期期末考试理科化学试卷(带解析) 题型:填空题
甲醇是一种优质燃料,可制作燃料电池。
(1)工业上可用下列两种反应制备甲醇:
CO(g) + 2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
已知:2H2(g)+ O2(g) = 2H2O(g) ΔH3。则2CO(g)+O2(g) = 2CO2(g) 的反应热
ΔH=_____________(用ΔH1、ΔH2、ΔH3表示)。
(2)生产甲醇的原料CO和H2来源于:CH4(g) + H2O(g)  CO(g) + 3H2(g) ΔH4。
CO(g) + 3H2(g) ΔH4。
一定条件下CH4的平衡转化率与温度、压强的关系如图a。则ΔH4______0,P1_________P2
(填“<”、“>”或“=”)
(3)某实验小组设计如图b所示的甲醇燃料电池装置,工作一段时间后,溶液的PH (填增大、减小、不变)。负极的电极反应式为_______ ______。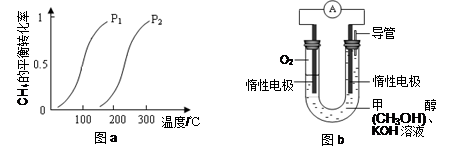
(4)黄铜矿熔炼后得到的粗铜含少量Fe、Ag、Au等金属杂质,需进一步采用电解法精制。粗铜电解得到精铜的的电解池中,阳极材料是 ;阴极材料是 ;
阳极泥为:
查看答案和解析>>
科目:高中化学 来源:2014届辽宁省高二第二次月考化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.任何酸与碱发生中和反应生成1molH2O的过程中,能量变化均相同
B.同温同压下,H2 (g)+Cl2(g)= 2HCl(g)在光照和点燃条件下的△H不同
C.已知:①2H2(g) +O2(g) =2H2O(g) △H=-a kJ·mol-1,
②2H2(g)+O2 (g)= 2H2O(1) △H=-b kJ·mol-1,则a>b
D.已知:①C(s,石墨)+O2 (g)=CO2(g) △H=- 393.5kJ·mol-1,
②C(s,金刚石)+O2(g)=CO2 (g) △H=- 395.0 kJ·mol-1,
则C(s,石墨)=C(s,金刚石)△H=+1.5 kJ.mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com