
| A. | 制取粗硅 | B. | 用生石灰干燥氨气 | ||
| C. | 浓氨作制冷剂 | D. | 实验室中用棕色试剂瓶装浓HNO3 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 从上到下氢化物的熔沸点逐渐升高 | |
| B. | 从上到下单质的还原性逐渐减弱 | |
| C. | 从上到下最高价氧化物的水化物酸性逐渐减弱 | |
| D. | 从上到下原子得电子的能力逐渐增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

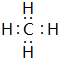 .
. .
.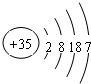 ,其在周期表中的位置为第四周期ⅦA族,该元素的符号为Br;上表中与其同主族的元素为氯(填元素名称),通过简单实验可比较这两种元素非金属性的强弱(实验简单、现象明显),写出该实验原理的离子反应方程式Cl2+2Br-=Br2+2Cl-.
,其在周期表中的位置为第四周期ⅦA族,该元素的符号为Br;上表中与其同主族的元素为氯(填元素名称),通过简单实验可比较这两种元素非金属性的强弱(实验简单、现象明显),写出该实验原理的离子反应方程式Cl2+2Br-=Br2+2Cl-.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
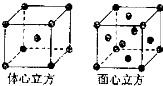 Mn、Fe均为第四周期过渡元素.请回答下列问题:
Mn、Fe均为第四周期过渡元素.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
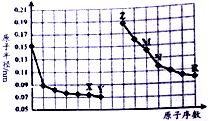
| A. | Y、R两种元素的气态氢化物稳定性大小:Y<R | |
| B. | 简单离子的半径:X>Z>M | |
| C. | 由X于N两种元素组成的化合物不能与任何酸反应,但能与强碱反应 | |
| D. | Z单质能从M与R元素构成的盐溶液中置换出单质M |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O | |
| B. | 氯化亚铁溶液和稀硝酸混合:3Fe2++4H++NO3-═3Fe3++2H2O+NO↑ | |
| C. | AlCl3溶液中加入足量的氨水:Al3++4OH-═AlO2-+2H2O | |
| D. | NO2溶于水:3NO2+H2O═2H++2NO3-+NO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 转变为的
转变为的 操作是( )
操作是( )| A. | 先与NaOH溶液共热,再通人足量C02 | B. | 先与NaOH溶液共热,冉通人足量HC1 | ||
| C. | 先与稀H2S04共热,加人足量Na2CO3 | D. | 先与稀H2S04共热,加人足量NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
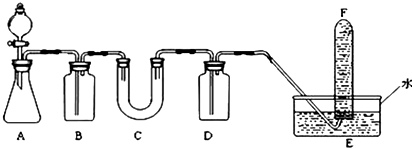
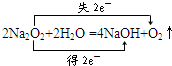 ,所以
,所以查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在熔融电解质中,O2-由正极移向负极 | |
| B. | 电解一共生成0.9 mol气体时,理论上消耗0.1 mol丁烷 | |
| C. | 电解池的阳极反应式为4OH--4e-═2H2O+O2↑ | |
| D. | 通入空气的一极是正极,电极反应式为O2+4e-═2O2- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com