
肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题
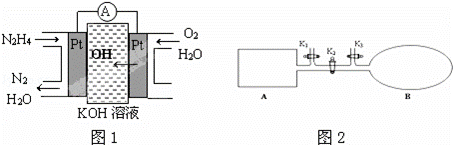
(1)肼燃料电池原理如图1所示,左边电极上发生的电极反应式为 .
(2)火箭常用N2O4作氧化剂,肼作燃料,已知:
N2(g)+2O2(g)=2NO2(g)△H=﹣67.7kJ•mol﹣1
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=﹣534.0kJ•mol﹣1
2NO2(g)⇌N2O4(g)△H=﹣52.7kJ•mol﹣1
试写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式: .
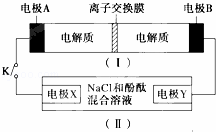
(3)如图2所示,A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的透明气囊.关闭K2,将各1mol NO2通过K1、K3分别充入A、B中,反应起始时A、B的体积相同均为a L.
①B中可通过 判断可逆反应2NO2⇌N2O4已经达到平衡.
②若打开K2,平衡后B容器的体积缩至0.4a L,则打开K2之前,气球B体积为 L.
考点:
化学电源新型电池;用盖斯定律进行有关反应热的计算;化学平衡建立的过程.
专题:
基本概念与基本理论.
分析:
(1)左端为负极,在碱性电解质中失去电子生成氮气和水;
(2)利用盖斯定律来计算2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)的反应热;
(3)①反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化;
②根据等效平衡分析.
解答:
解:(1)左端为负极,在碱性电解质中失去电子生成氮气和水,电极反应为N2H4﹣4e﹣+4OH﹣=N2+4H2O,故答案为:N2H4﹣4e﹣+4OH﹣=N2+4H2O;
(2)由①N2(g)+2O2(g)=2NO2(g)△H=﹣67.7kJ•mol﹣1
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=﹣534.0kJ•mol﹣1
③2NO2(g)⇌N2O4(g)△H=﹣52.7kJ•mol﹣1
根据盖斯定律可知②×2﹣①﹣③得2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g),
△H=(﹣534.0kJ•mol﹣1)×2﹣(﹣67.7kJ•mol﹣1)﹣(﹣52.7kJ•mol﹣1)=﹣947.6 kJ•mol﹣1,
即热化学方程式为2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=﹣947.6 kJ•mol﹣1,
故答案为:2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=﹣947.6 kJ•mol﹣1;
(3)①B是一个气体压强不变的容器,所以当反应达到平衡状态时,混合气体的颜色和气囊体积不再改变,
故答案为:B的体积不再减小或气体颜色不再变化;
②打开K2,则相当于是在等温等压时的平衡,因此平衡时等效的.由于此时反应物的物质的量是B中的二倍,所以打开K2之前,气球B体积为(aL+0.4aL)÷2=0.7aL,
故答案为:0.7a.
点评:
本题考查了化学平衡、原电池 原理和盖斯定律等知识点,难点是根据等效平衡进行计算,难度较大.


科目:高中化学 来源: 题型:
在不同条件下分别测得2SO2+O2⇌2SO3的化学反应速率,其中表示该反应进行最快的是( )
|
| A. | υ(SO2)=4 mol/(L•min) | B. | υ(O2)=0.1 mol/(L•s) |
|
| C. | υ(O2)=3mol/(L•min ) | D. | υ(SO2)=0.1 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:
某酸HX的稀溶液和某碱YOH的稀溶液的物质的量浓度相等,两溶液混合后,溶液的PH大于7,表中判断合理的是( )
| 编号 | HX | YOH | 溶液的体积关系 |
| ① | 强酸 | 强碱 | V(HX)=V(YOH) |
| ② | 强酸 | 强碱 | V(HX)<V(YOH) |
| ③ | 强酸 | 弱碱 | V(HX)=V(YOH) |
| ④ | 弱酸 | 强碱 | V(HX)=V(YOH) |
|
| A. | ①③ | B. | ②③ | C. | ①④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应2SO2(g)+O2(g)⇌2SO3(g)△H<0,向某体积恒定的密闭容器中按体积比2:1充入SO2和O2,在一定条件下发生反应.下图是某物理量(Y)随时间(t)变化的示意图(图中T表示温度),Y可以是( )

|
| A. | SO2的转化率 | B. | 混合气体的密度 |
|
| C. | 密闭容器内的压强 | D. | O2的体积分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
如图装置Ⅰ为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池充、放电的化学方程式为2K2S2+KI3 K2S2+3KI装置Ⅱ为电解池的示意图.当闭合开关K时,X附近溶液先变红,下列说法正确的是( )
K2S2+3KI装置Ⅱ为电解池的示意图.当闭合开关K时,X附近溶液先变红,下列说法正确的是( )
|
| A. | K+从右到左通过离子交换膜 |
|
| B. | 电极A的反应式:I3﹣+2e﹣=3I﹣ |
|
| C. | 电极X的反应式:4OH﹣﹣4e﹣═O2↑+2H2O |
|
| D. | 当电极Y有0.2mole﹣转移时,产生0.1molCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子浓度在指定溶液中一定能大量共存的是
①加入铝能放出H2的溶液中:Al3+、Fe2+、Cl-、N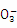 、S2-
、S2-
②使pH=11的溶液中:Na+、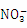 、
、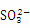 、
、 、S2-
、S2-
③由水电离出的c(H+)=10-12mol/L的溶液中:Na+、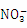 、
、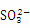 、
、 、S2-
、S2-
④能使淀粉碘化钾试纸显蓝色的溶液:K+、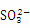 、
、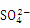 、S2-、OH-
、S2-、OH-
⑤使甲基橙变红的溶液中:Fe3+、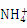 、Cl-、K+、
、Cl-、K+、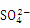
| A.③④ | B.②④ | C.②⑤ | D.①⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
具有下列电子层结构的原子,其第一电离能由大到小排列正确的是
①3p轨道上只有一对成对电子的原子;②外围电子构型为3s23p6的原子;
③其3p轨道为半满的原子;④正三价的阳离子结构与氖相同的原子。
| A.①②③④ | B.③①②④ | C.②③①④ | D.②④①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列几种氢键:①O—H…O、②N—H…N、③F—H…F、④O—H…N,按氢键从强到弱的顺序正确的是
| A.③>①>④>② | B.①>②>③>④ |
| C.③>②>①>④ | D.①>④>③>② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com