
化学能与电能之间的相互转化与人类的生活实际密切相关,在生产、生活中有重要的应用,同时也是学生形成化学学科素养的重要组成部分。
(1)熔融状态下,钠的单质和氯化亚铁能组成可充电电池,如图9-8工作原理示意图,反应原理为2Na+FeCl2 Fe+2NaCl,该电池放电时,正极反应式为________________________________________________________________________;
Fe+2NaCl,该电池放电时,正极反应式为________________________________________________________________________;
充电时,____________(写物质名称)电极接电源的负极;该电池的电解质为________。

(2)某同学用铜片、石墨作电极电解一定浓度的硫酸铜溶液,工作原理示意图如图所示,一段时间停止通电取出电极。若在电解后的溶液中加入0.98 g氢氧化铜粉末恰好完全溶解,经测定所得溶液与电解前完全相同。请回答下列问题:
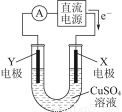
①Y电极材料是________,发生________(填“氧化”或“还原”)反应。
②电解过程中X电极上发生的电极反应式是_______________________________________________________________________。
③如在电解后的溶液中加入足量的小苏打,充分反应后产生气体在标准状况下所占的体积是__________。
(1)Fe2++2e-=Fe 钠 β—Al2O3
(2)①石墨 氧化
②Cu2++2e-=Cu 2H++2e-=H2↑或2H2O+2e-=H2↑+2OH-
③0.448 L或448 mL
【解析】(1)该电池的电解质为熔融的β?Al2O3,熔融的钠电极作负极,钠发生失电子的氧化反应;熔融的FeCl2电极作正极,Fe2+发生得电子还原反应,充电时,电池负极接电源负极,电池正极接电源正极。(2)由加入Cu(OH)2可使电解质溶液复原,可知阳极为石墨,阴极为铜片。相当于惰性电极电解硫酸铜溶液,硫酸铜消耗完后又电解的水,故阴极首先发生的反应为Cu2++2e-=Cu,Cu2+消耗尽后又发生反应2H++2e-=H2↑。根据电子守恒和铜元素的守恒,溶液中生成的n(H+)=2n(Cu2+)=2×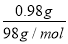 =0.02 mol,与足量NaHCO3反应可产生0.02 mol CO2。
=0.02 mol,与足量NaHCO3反应可产生0.02 mol CO2。


 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源:2014高考化学名师知识点精编 专题15富集在海水的元素-氯溴碘练习卷(解析版) 题型:选择题
在氯水中存在多种分子和离子,可通过实验的方法加以确定,下列说法中可能错误的是( )
A.加入含有NaOH的酚酞试液,红色褪去,说明有H+存在
B.加入有色布条后,有色布条褪色,说明有HClO分子存在
C.氯水呈浅黄色,且有刺激性气味,说明有Cl2分子存在
D.加入硝酸酸化的AgNO3溶液产生白色沉淀,说明有Cl-存在
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题11电化学练习卷(解析版) 题型:选择题
1 L K2SO4和CuSO4的混合溶液中c(S )=2.0 mol·L-1,用石墨电极电解此溶液,当通电一段时间后,两极均收集到22.4 L(标准状况)气体,则原溶液中c(K+)为( )
)=2.0 mol·L-1,用石墨电极电解此溶液,当通电一段时间后,两极均收集到22.4 L(标准状况)气体,则原溶液中c(K+)为( )
A.2.0 mol·L-1 B.1.5 mol·L-1
C.1.0 mol·L-1 D.0.5 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题10盐类水解与沉淀溶解平衡练习卷(解析版) 题型:选择题
蒸干FeCl3水溶液后再加强热,得到的固体物质主要是( )
A.FeCl3 B.FeCl3·6H2O C.Fe(OH)3 D.Fe2O3
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题9电化学原理练习卷B(解析版) 题型:选择题
图中X为电源,Y为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,通电后Y中央的紫红色色斑向d端扩散。下列判断正确的是( )
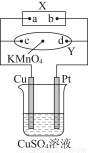
A.滤纸上c点附近会变红色
B.Cu电极质量减小,Pt电极质量增大
C.烧杯中溶液的pH先减小,后增大
D.烧杯溶液中SO42-向Cu电极定向移动
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题9电化学原理练习卷A(解析版) 题型:选择题
科学家们在研制一种吸气式的锂—空气电池,工作时吸收空气中的氧气在多孔金制成的正极表面上反应。总反应可表示为2Li+O2 Li2O2,下列有关说法正确的是( )
Li2O2,下列有关说法正确的是( )
A.充电时,多孔金制成的电极外接电源负极
B.放电时,吸收空气中22.4 L的O2,就有2 mol e-从电池负极流出
C.放电时,Li+从负极向正极移动
D.该电池可使用含Li+的水溶液作电解质溶液
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题8电解质溶液练习卷B(解析版) 题型:填空题
常温下,向100 mL 0.01 mol·L-1 HA溶液中逐滴加入0.02 mol·L-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。
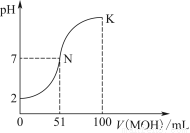
回答下列问题:
(1)由图中信息可知HA为________酸(填“强”或“弱”),理由是________________________________________________。
(2)常温下一定浓度的MA稀溶液的pH=a,则a________________________________________________________7
(填“>”“<”或“=”),用离子方程式表示其原因为_____________________________________________________
此时,溶液中由水电离出的c(OH-)=________。
(3)请写出K点所对应的溶液中离子浓度的大小关系:_________________________________________。
(4)K点对应的溶液中,c(M+)+c(MOH)________2c(A-)(填“>”“<”或“=”);若此时溶液中,pH=10,则c(M+)-c(OH-)=________mol·L-1。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题8电解质溶液练习卷A(解析版) 题型:选择题
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号 | c(HA)/mol·L-1 | c(NaOH)/mol·L-1 | 混合后溶液的pH |
甲 | 0.2 | 0.2 | pH=a |
乙 | b | 0.2 | pH=7 |
丙 | 0.2 | 0.1 | pH<7 |
丁 | 0.1 | 0.1 | pH=c |
下列对混合后溶液的有关说法中,不正确的是( )
A.甲中:若a=7,则HA是强酸
B.乙中:若b≠0.2,则c(A-)≠c(Na+)
C.丙中:若HA是弱酸,则c(A-)>c(Na+)>c(H+)>c(OH-)
D.丁中:若c=9,则c(OH-)-c(HA)=10-9 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题5化学反应中的能量变化练习卷(解析版) 题型:填空题
(1)在焙烧炉中发生反应:
①Fe2O3(s)+3C(s)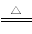 2Fe(s)+3CO(g) ΔH=-492.7 kJ·mol-1
2Fe(s)+3CO(g) ΔH=-492.7 kJ·mol-1
②3CO(g)+Fe2O3(s) 2Fe(s)+3CO2(g) ΔH=+25.2 kJ·mol-1
2Fe(s)+3CO2(g) ΔH=+25.2 kJ·mol-1
反应2Fe2O3(s)+3C(s) 4Fe(s)+3CO2(g) ΔH=________kJ·mol-1。
4Fe(s)+3CO2(g) ΔH=________kJ·mol-1。
(2)天然气(以甲烷计)在工业生产中用途广泛。甲烷蒸汽转化法制H2的主要转化反应如下:
CH4 (g)+H2O(g) CO(g)+3H2(g) ΔH=+206.2 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.2 kJ·mol-1
CH4(g)+2H2O(g) CO2(g)+4H2(g) ΔH=+165.0 kJ·mol-1
CO2(g)+4H2(g) ΔH=+165.0 kJ·mol-1
上述反应所得原料气中的CO能使氨合成催化剂中毒,必须除去。工业上常采用催化剂存在下CO与水蒸气反应生成易除去的CO2,同时又可制得等体积的氢气的方法。此反应称为一氧化碳变换反应,该反应的热化学方程式是_________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com