
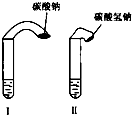
 (1)高中教材中有这样一个实验:在两支试管中分别加入3mL稀盐酸(均足量)(只有浓度小于1mol?L-1的稀盐酸跟Na2CO3和NaHCO3反应才能根据反应的剧烈程度区分开来,浓度较高则反应现象都是同样的剧烈),将两个各装有0.3g NaHCO3和Na2CO3粉末的小气球分别套在两支试管口上.将气球内的NaHCO3和Na2CO3同时倒入试管中,观察到现象如下:
(1)高中教材中有这样一个实验:在两支试管中分别加入3mL稀盐酸(均足量)(只有浓度小于1mol?L-1的稀盐酸跟Na2CO3和NaHCO3反应才能根据反应的剧烈程度区分开来,浓度较高则反应现象都是同样的剧烈),将两个各装有0.3g NaHCO3和Na2CO3粉末的小气球分别套在两支试管口上.将气球内的NaHCO3和Na2CO3同时倒入试管中,观察到现象如下:| 序号 | 试剂1 | 试剂2 | 混合前温度 | 混合后最高或最低温度 |
| A | 50mL水 | 2.5g NaHCO3固体 | 20℃ | 18.5℃ |
| B | 50mL水 | 3.2g Na2CO3固体 | 20℃ | 23.3℃ |
| C | 50mL稀盐酸 | 2.5g NaHCO3固体 | 20℃ | 17.4℃ |
| D | 50mL稀盐酸 | 3.2g Na2CO3固体 | 20℃ | 24.4℃ |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| A、Q2-Q1 |
| B、Q1+Q2 |
| C、Q1-Q2 |
| D、-Q1-Q2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 在一个U形管里盛有氯化铜溶液,并插入两块锌片作电极,按如图1连接.
在一个U形管里盛有氯化铜溶液,并插入两块锌片作电极,按如图1连接.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、75.2mL |
| B、85.5mL |
| C、90.8mL |
| D、100mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com