
【题目】镍电池开始应用于新能源汽车,但电池使用后电极材料对环境还是有一定的危害, 某型号镍电池的电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。研究小组设计如下工艺流程,对该电池的电极材料进行资源回收:
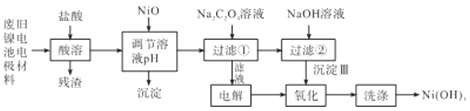
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②实验温度时的溶解度:NiC2O4> NiC2O4H2O> NiC2O42H2O
③某温度下:Ksp[Ni(OH)2] = 5.0×10-16、Ksp[NiC2O4]=4.0×10-10、Ksp[Fe(OH)3]=4.0×10-38、Ksp[Al(OH)3]=3.0×10-34
回答下列问题:
(1)用NiO调节溶液的pH,首先析出的沉淀是__________,控制这两种沉淀能够依次析出可利用________(仪器名称)。
(2)过滤①得到的沉淀为___________,洗涤Ni(OH)3沉淀的方法是__________。
(3)写出加入NaOH溶液发生反应的离子方程式_________,该反应的化学平衡常数K=_________。
(4)电解过程中阴极反应式为___________,沉淀Ⅲ可被电解所得产物之一氧化,写出“氧化”的离子方程式____________。
(5)铁镍蓄电池的电池总反应为Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2,该电池的电解液为___________(填“酸性”或“碱性”)溶液,充电时正极的电极反应式为_________。
【答案】(1)Fe(OH)3,pH计(或pH传感器);
(2)NiC2O42H2O,向漏斗中加蒸馏水至浸没固体,待其自然流干后重复2~3次;
(3)NiC2O4+2OH-==Ni(OH)2+C2O42-,8.0×105;
(4)2H2O+2e-==H2↑+2OH-(或2H++2e-==H2↑),2Ni(OH)2+2OH-+Cl2═=2Ni(OH)3+2Cl-;
(5)碱性,2Ni(OH)2-2e-+2OH-==Ni2O3+3H2O。
【解析】
试题分析:(1)根据溶度积的数量级,Fe(OH)3最小,因此调节pH,Fe3+先沉淀出来,即Fe(OH)3,Fe3+和Al3+转化成沉淀,需要控制溶液的OH,因此需要OH计;(2)过滤①加入Na2C2O4且根据信息②,出现的沉淀是NiC2O4·2H2O,洗涤沉淀的方法是:向漏斗中加蒸馏水至浸没固体,待其自然流干后重复2~3次;(3)过根据溶度积,沉淀转化成更难溶的Ni(OH)2,因此离子反应式为NiC2O4+2OH-=Ni(OH)2+C2O42-,K=c(C2O42-)/c2(OH-)=c(C2O42-)×c(Ni2+)/=c(C2O42-)×c(Ni2+)/[c2(OH-)×(c(Ni2+)]=Ksp(NiC2O4)/Ksp(Ni(OH)2=4×10-10/5×10-16=8.0×105;(4)电解液为氯化钠的水溶液,根据电解原理,阳离子在阴极放电,按照放电顺序是H+放电,即2H2O+2e-=H2↑+2OH-,阳极上反应式是2Cl--2e-=Cl2↑,因此氧化的离子反应式为:2Ni(OH)2+2OH-+Cl2=2Ni(OH)3+2Cl-;(5)产物是Fe(OH)2和Ni(OH)2,因此电解液为碱性,充电时电池的正极接电源的正极,反应式是正极反应式的逆过程,因此是2Ni(OH)2-2e-+2OH-=Ni2O3+3H2O。


科目:高中化学 来源: 题型:
【题目】钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。
①Ti的基态原子价电子排布式为________________。
②Fe的基态原子共有________种不同能级的电子。
(2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4===2KCl+2CrO2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由大到小的顺序是______________(用元素符号表示)。
②COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为____________,中心原子的杂化方式为____________。
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为6.9×10-2 nm和7.8×10-2 nm。则熔点:NiO____________(填“>”、“<”或“=”)FeO。
(4)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。
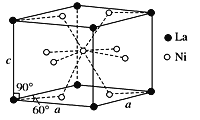
①该晶体的化学式为________________。
②已知该晶胞的摩尔质量为M g·mol-1,密度为d g·cm-3。设NA为阿伏加德罗常数的值,则该晶胞的体积是____________cm3(用含M、d、NA的代数式表示)。
[化学—选修5:有机化学基础]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制一定体积一定浓度的NaOH溶液时,下列操作导致结果偏高的是
A.称量NaOH固体时动作缓慢 B.定容时俯视刻度线
C.定容后振荡发现液面低于刻度线 D.未洗涤烧杯和玻璃棒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下存在反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),ΔH<0。现有三个相同的2L恒
CO2(g)+H2(g),ΔH<0。现有三个相同的2L恒
容绝热(与外界没有热量交换) 密闭容器I、II、III,在I中充入1 mol CO和1 mol H2O,在II中充入1 mol CO2和1 mol H2,在III中充入2 mol CO 和2 mol H2O,700℃条件下开始反应。达到平衡时,下列说法正确的是( )
A. 容器I、II中正反应速率相同
B. 容器I中CO 的物质的量比容器II中的多
C. 容器I、III中反应的平衡常数相同
D. 容器I中CO 的转化率与容器II中CO2的转化率之和等于1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学一选修3:物质结构与性质】
铜也是日常生活中常见的金属,它的单质及化合物在科学研究和工农业生产中具有广泛的用途。请回答以下问題:
(1)超细铜粉可用作导电材料、傕化剂等,制备方法如下:
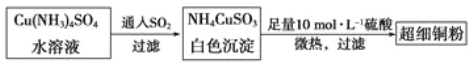
写出基态Cu的外围电子排布式________________,铜元素位于周期表中笫______________族;NH4CuSO3所含元素中第一电离能最大是____________(填元素符号)。
SO42-中心原子的杂化方式为___________,SO32-的空间构型为__________。
③ 将NH4CuSO3溶于足量稀硫酸中,有剌激性气味的气体放出,该气体是__________,所得溶液呈__________色。
(2)某学生向CuSO4浓液中加入少量氨水生成蓝色沉淀,继续加入过量氨水沉淀溶解,得到 深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4 H2O晶体。
①下列说法正确的是_______(填代号)
A.氨气极易溶于水,是因为NH3和H2O之间形成了极性共价键
B.NH3和H2O中心原子的杂化方式相同,键角也相同
c.Cu(NH3)4SO4所含的化学键有离子键、极性键和配位键
d.[Cu(NH3)4]SO4中配离子的空间构型为正方形
②请解释加入乙醇后析出晶体的原因________________。
(3)Cu晶体的堆积方式如右图所示,设Cu原子半径为a,晶体中Cu原子的配位数为______________,晶体的空间利用率为________________。(已知:![]() ,列式并计算出结果)
,列式并计算出结果)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与日常生活密切相关,下列说法错误的是( )
A. 氢氧化铝可作抗酸药 B. “84”消毒液的有效成分是NaClO
C. 浓硫酸可刻蚀石英制艺术品 D. 酱油中添加的补铁剂中含有维生素C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO是现代化工生产的基础原料,下列有关问题都和CO的使用有关。
(1) 工业上可利用CO生产乙醇:
2CO(g)+4H2(g)![]() CH3CH2OH(g)+H2O(g) ΔH1
CH3CH2OH(g)+H2O(g) ΔH1
又已知:H2O(l)=== H2O(g) ΔH2
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH3
CO2(g)+H2(g) ΔH3
工业上也可利用CO2(g)与H2(g)为原料合成乙醇:
2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(l) ΔH
CH3CH2OH(g)+3H2O(l) ΔH
则:ΔH与ΔH1、ΔH2、ΔH3之间的关系是:ΔH=___________________。
(2)一定条件下,H2、CO在体积固定的密闭容器中发生如下反应:
4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g),下列选项能判断该反应达到平衡状态的依据的有___ 。
CH3OCH3(g)+H2O(g),下列选项能判断该反应达到平衡状态的依据的有___ 。
A.2v(H2)= v(CO)
B.CO的消耗速率等于CH3OCH3的生成速率
C.容器内的压强保持不变
D.混合气体的密度保持不变
E.混合气体的平均相对分子质量不随时间而变化
(3)工业可采用CO与H2反应合成再生能源甲醇,反应如下:
CO(g)+ 2H2(g)![]() CH3OH(g)在一容积可变的密闭容器中充有10molCO和20molH2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)、压强(p)的关系如(图1)所示。
CH3OH(g)在一容积可变的密闭容器中充有10molCO和20molH2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)、压强(p)的关系如(图1)所示。

①合成甲醇的反应为 (填“放热”或“吸热”)反应。
②A、B、C三点的平衡常数KA、KB、KC的大小关系为 。
③若达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为_________L。
④(图2)中虚线为该反应在使用催化剂条件下关于起始氢气与CO投料比和CO平衡转化率的关系图. 当其条件完全相同时,用实线画出不使用催化剂情况下CO平衡转化率的示意图.
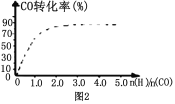
⑤CO的平衡转化率(α)与温度(T)、压强(p)的关系如(图3)所示,实际生产时条件控制在250 ℃、 1.3×104 kPa左右,选择此压强的理由是__________________。
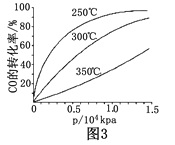
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮及其化合物在工农业生产生活中有着重要作用,请回答下列问题:
(1)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2
若2 molCH4还原NO2至N2,整个过程中放出的热量为1734 kJ,则△H2=_________;
(2)据报道,科学家在一定条件下利用Fe2O3与甲烷反应可制取“纳米级”的金属铁,其反应如下:Fe2O3(s)+3CH4(g)===2Fe(s)+3CO(g)+6H2(g) △H>0
① 若反应在5 L的密闭容器中进行,1 min后达到平衡,测得Fe2O3在反应中质量减少3.2g。则该段时间内CO的平均反应速率为__________mol/(L·s)
② 若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是__________(选填序号)
A.CH4的转化率等于CO的产率
B.混合气体的平均相对分子质量不变
c.v(CO)与v(H2)的比值不变
D.固体的总质量不变
③该反应达到平衡时某物理量随温度变化如图所示,当温度由T1升高到T2时,平衡常数KA________KB(填“>”、“<”或“=”),纵坐标表示的物理量可能是__________(填字母)。
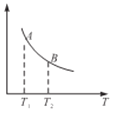
A.H2的逆反应速率
B.CH4的的体枳分数
C.混合气体的平均相对分子质量
D.CO的体积分数
(3)而一些科学家采用高质子导电性的SCY陶瓷(能传递H+)实现氨的电化学合成,从而大大提高了氮气和氢气的转化率。电化学合成氨过程的总反应式为N2+3H2![]() 2NH3,该过程中还原反应的方程式为________________。
2NH3,该过程中还原反应的方程式为________________。
(4)若往20 mL0.01mol/L的弱酸HNO2溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如下图所示,下列有关说法正确的是_____________(填标号)
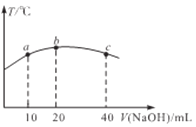
①该烧碱溶液的浓度为0.02mol/L
②该烧碱溶液的浓度为0.01mol/L
③HNO2的电离平衡常数:b点>a点
④从b点到c点,混合溶液中一直存在:c(Na+)> c(NO2-) >c(OH-)> c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用大理石粉末与3mol/L盐酸反应制取CO2气体,若要增大反应速率,可采取的措施是( )
A. 加入水 B. 改用1mol/L盐酸 C. 改用块状大理石 D. 适当升高温度.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com