
| A、大于3.2 g |
| B、等于3.2 g |
| C、小于3.2 g |
| D、任意质量 |
| ||
| ||


 星级口算天天练系列答案
星级口算天天练系列答案科目:高中化学 来源: 题型:
| A、用NaClO除去水体中CO(NH2)2产生CO2和N2,3ClO-+CO(NH2)2═3Cl-+CO2↑+N2↑+2H2O |
| B、过氧化氢能使酸性KMnO4溶液褪色:3H2O2+2MnO4-+6H+═2Mn2++4O2↑+6H2O |
| C、用小苏打治疗胃酸过多:CO32-+2H+═CO2↑+H2O |
| D、向Ba(OH)2溶液中逐滴加入溶液恰好沉淀完全:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
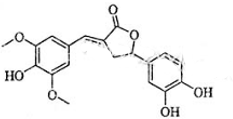
| A、分子含有三种含氧官能团 |
| B、1mol该化合物最多能与6mol NaOH反应 |
| C、既可以发生取代反应,又能够发生加成反应 |
| D、既能与FeCl3发生显色反应,也能与NaHCO3反应放出CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、二氧化硅的分子式 SiO2 | ||
| B、氧化铁的化学式:FeO | ||
C、次氯酸的电子式 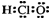 | ||
D、中子数为78的碘原子:
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙二醇可用来生产聚酯纤维和作汽车发动机的抗冻剂 |
| B、乙醇是可再生能源,应大力推广“乙醇汽油”,含酒精的饮料中含有浓度不等的乙醇,75%(质量分数)的乙醇溶液常用于医疗消毒 |
| C、煤中含有煤焦油及多种化工原料,可通过煤的气化获得 |
D、据环保部门调查,2013年末,造成杭州自来水异味的元凶为邻叔丁基苯酚: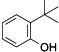 ,饮用含有该物质的水,对人体健康无任何不利影响 ,饮用含有该物质的水,对人体健康无任何不利影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、与水或酸反应置换氢气越来越剧烈 |
| B、对应元素的金属性由弱到强 |
| C、对应金属阳离子氧化性由弱到强 |
| D、原子半径由小到大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将等体积、等pH的氢氧化钠溶液和氨水分别稀释相同倍数,氨水的pH变化大 |
| B、金属钾、钠和白磷等暴露在空气中易燃烧,所以金属钾、钠和白磷应保存在煤油中 |
| C、向滴有酚酞的Na2CO3溶液中逐滴加入Ba(NO3)2,红色逐渐褪去,说明Na2CO3溶液中存在水解平衡 |
| D、在制备硝酸钾晶体的实验中,趁热过滤时,承接滤液的小烧杯中先加2mL的水,以防过滤时硝酸钾晶体过早析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
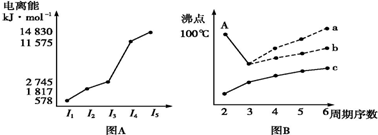
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com