
| A. | 钢铁腐蚀时可能发生的正极反应为:2H2O+O2+4e-=4OH- | |
| B. | 向沸水中滴入几滴FeC13溶液:Fe3++3H2O=Fe(OH)3↓+3H+ | |
| C. | 1L0.5mol•L-1稀硫酸与1L1mol•L-1氢氧化钠溶液反应放出57.3kJ的热量: H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(1);△H=-114.6kJ•mol-1 | |
| D. | 向KHSO4溶液中滴入Ba(OH)2溶液使pH=7:SO42-+2H++Ba2++2OH-=BaSO4↓+2H2O |
分析 A.钢铁发生吸氧腐蚀时,正极氧气得到电子被还原;
B.胶体不是沉淀;
C.1mol硫酸与2mol氢氧化钠反应生成2mol水,放出114.6KJ的热量;
D.二者2:1反应溶液呈中性.
解答 解:A.钢铁发生吸氧腐蚀时,正极氧气得到电子被还原,电极反应式为:2H2O+O2+4e-=4OH-,故A正确;
B.向沸水中滴入几滴FeC13溶液,离子方程式:Fe3++3H2O=Fe(OH)3(胶体)+3H+,故B错误;
C.1L0.5mol•L-1稀硫酸与1L1mol•L-1氢氧化钠溶液反应放出57.3kJ的热量:H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(1);△H=-114.6kJ•mol-1,故C正确;
D.向KHSO4溶液中滴入Ba(OH)2溶液使pH=7,离子方程式:SO42-+2H++Ba2++2OH-=BaSO4↓+2H2O,故D正确;
故选:B.
点评 本题考查了离子方程式的书写,明确钢铁吸氧腐蚀、熟悉离子方程式书写方法是解题关键,题目难度不大.


 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:填空题
 ;
;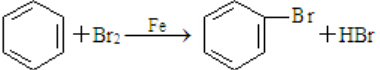 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2项 | B. | 3项 | C. | 4项 | D. | 5项 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该燃料绿色环保,在燃烧过程中不会造成任何环境污染 | |
| B. | 该反应中N2O4是氧化剂,偏二甲肼是还原剂 | |
| C. | N2既是氧化产物又是还原产物,CO2既不是氧化产物也不是还原产物 | |
| D. | 每有0.6 mol N2生成,转移电子数目为2.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | abcd | B. | bcd | C. | acd | D. | abc |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
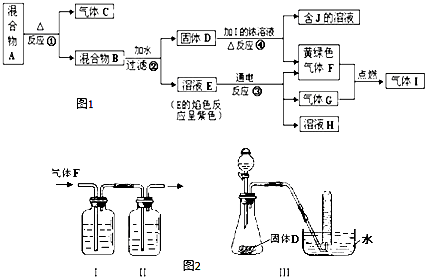
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
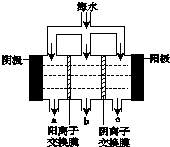 《科学》曾评出10大科技突破,其中“火星上‘找’到水的影子”名列第一.水是一种重要的自然资源,是人类赖以生存不可缺少的物质.水质优劣直接影响人体健康.海洋是化学资源宝库,海洋资源的综合利用具有广阔的前景.人类把海水淡化,就可以得到大量的饮用水,常规蒸馏法,技术和工艺比较完备,但也存在较大缺陷,大量推广离子交换法和电渗析法.
《科学》曾评出10大科技突破,其中“火星上‘找’到水的影子”名列第一.水是一种重要的自然资源,是人类赖以生存不可缺少的物质.水质优劣直接影响人体健康.海洋是化学资源宝库,海洋资源的综合利用具有广阔的前景.人类把海水淡化,就可以得到大量的饮用水,常规蒸馏法,技术和工艺比较完备,但也存在较大缺陷,大量推广离子交换法和电渗析法.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、H+、SO42-、OH- | B. | Ca2+、Na+、NO3-、CO32- | ||
| C. | Na+、H+、CO32-、Cl- | D. | Na+、Cl-、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{m(A-N)}{A}$ mol | B. | $\frac{m(A-N+2)}{A}$ mol | C. | $\frac{m(A-N-2)}{A}$ mol | D. | $\frac{m(A+N-2)}{A}$ mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com