
A、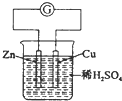 |
B、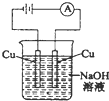 |
C、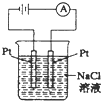 |
D、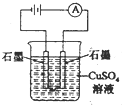 |
| ||


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:

| A、品红溶液中同时通入Cl2、SO2,漂白效果会更好 |
| B、加热可判断品红褪色是通入SO2还是通入Cl2引起的 |
| C、“无色化合物”分子中,19个碳原子都可能在同一平面上 |
| D、品红属于芳香烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
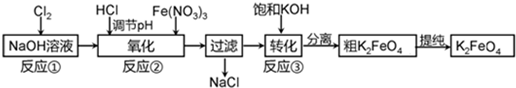
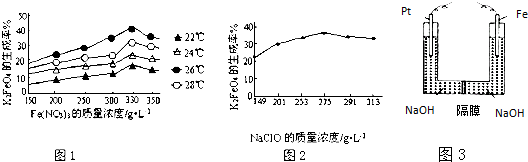
查看答案和解析>>
科目:高中化学 来源: 题型:
| H2O |
| 浓H2SO4 |
| △ |
| Mg |
| 无水乙酸 |
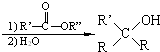
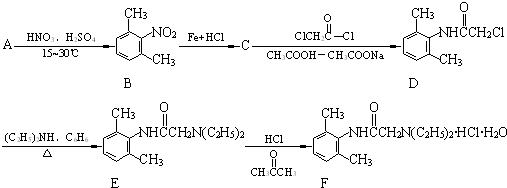
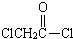 与足量的NaOH溶液共热充分反应的化学方程式:
与足量的NaOH溶液共热充分反应的化学方程式: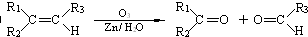
| BBr |
| NaOH溶液 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、N、O、S、Si的原子半径逐渐增大,非金属性逐渐减弱 |
| B、SO2和SiO2既能与NaOH溶液反应,又能与某些酸反应 |
| C、N、S的氧化物既是形成光化学烟雾,又是形成酸雨的主要物质 |
| D、N、Si、S的单质均能和氧气反应,且产物分别是NO2、SiO2和SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、每生成1mol Fe3O4,反应转移的电子总数为2 mol | ||
| B、也可在酸性条件下用该方法制备Fe3O4纳米颗粒 | ||
C、反应每消耗1mol Fe2+,被Fe2+还原的O2的物质的量为
| ||
| D、x=2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、阳离子不一定是金属离子,含阳离子的物质一定含阴离子 |
| B、阴、阳离子相互作用不一定形成离子化合物 |
| C、离子化合物均属于强电解质,都易溶于水 |
| D、由某金属元素的阳离子和某非金属元素阴离子组成的物质一定是纯净物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com