
分析 (1)由方程式可知,Fe元素化合价由0价变为+2价,则负极应为Fe,发生氧化反应生成Fe2+,正极为活泼性比铁弱的金属或非金属,发生还原反应,H+被还原生成H2,则电解质溶液为稀盐酸或稀硫酸;
(2)根据氢气和转移电子之间的关系式计算氢气体积.
解答 解:(1)由方程式可知,Fe元素化合价由0价变为+2价,则负极应为Fe,发生氧化反应生成Fe2+,电极反应式为Fe-2e-═Fe2+,电流从正极沿导线流向负极,所以负极上电流流入,
故答案为:Fe-2e-═Fe2+;流入;氧化反应;
(2)根据2H++2e-═H2↑知,生成22.4L氢气需要转移2×6.02×1023个e-,电子,则转移6.02×1022个e-生成氢气体积=$\frac{6.02×1{0}^{22}}{2×6.02×1{0}^{23}}$×22.4L=1.12L,
故答案为:1.12L.
点评 本题考查原电池设计,明确原电池原理是解本题关键,知道从化合价变化确定正负极、电解质溶液,题目难度不大.


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:多选题
| A. | 密度不变 | B. | 温度不变 | C. | 颜色不变 | D. | 压强不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 若气体是H2,则原溶液中还可能大量存在:NH4+、CO32-、SO42- | |
| B. | 若气体是H2,则原溶液中还可能大量存在:Ba2+、Cl-、NO3- | |
| C. | 若气体是NO,则原溶液中还可能大量存在:NH4+、Fe3+、SO42- | |
| D. | 若气体是NO,则原溶液中还可能大量存在:K+、Na+、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
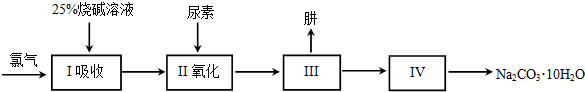
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 参加反应的CO2的体积为0.224 a L | |
| B. | 若a=b,则CO2与NaOH溶液反应的产物中盐只有Na2CO3 | |
| C. | b可能等于a、小于a或大于a | |
| D. | 不能确定NaOH溶液的物质的量浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
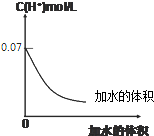
| A. | 若使溶液的pH升高1,可提高溶液的温度加水的体积 | |
| B. | 若使溶液的pH升高1,将溶液稀释到原体积的10倍 | |
| C. | 0.1 mol•L-1HIO3溶液稀释10倍后,溶液中c(H+)>c(IO3-)>c(HIO3) | |
| D. | 加水稀释过程中n(HIO3)+n((IO3-)减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯可作为水果的催熟剂 | |
| B. | 地沟油经过处理,可用来制造肥皂 | |
| C. | 煤炭燃烧过程安装固硫装置,可有效提高煤的利用率 | |
| D. | 发生地震后,防疫人员在震区周围撒石灰,进行环境消毒,防止灾后出现疫情 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验方案 | 实验目的 |
| A | 向酸性KMnO4溶液中滴加草酸溶液,观察紫色是否消失 | 验证草酸具有还原性 |
| B | 向相同浓度的NaBr和KI溶液中分别滴加足量氯水,观察溶液颜色变化 | 比较溴元素和碘元素的非金属性强弱 |
| C | 将铜与浓硝酸反应生成的气体收集后用冰水混合物冷却降温 | 研究温度对化学平衡的影响 |
| D | 将Mg(OH)2沉淀转入烧杯中,加足量稀硫酸溶解,加热浓缩,冷却结晶 | 制备硫酸镁晶体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,50g 98%浓硫酸和50g 98%浓磷酸混合后含氧原子数为4NA | |
| B. | 标准状况下,活泼金属与稀硫酸反应转移2NA个电子时,可产生22.4L气体 | |
| C. | 6.4g SO2溶于水配成1L溶液,含有H2SO3的分子数为0.1NA | |
| D. | 1mol C3H6分子中碳碳共价键数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com