
| A. | 1 mol CuSO4•5H2O的质量为250g/mol | |
| B. | 125g CuSO4•5H2O的物质的量为0.5 mol | |
| C. | CuSO4•5H2O的摩尔质量为250g | |
| D. | 配制100mL 0.1mol/L 硫酸铜溶液需要CuSO4•5H2O 1.6g |
分析 A.结合m=nM计算;
B.结合n=$\frac{m}{M}$计算;
C.摩尔质量的单位为g/mol;
D.配制100mL 0.1mol/L 硫酸铜溶液,溶质物质的量为0.1L×0.1mol/L=0.01mol,结合m=nM计算.
解答 解:A.1 mol CuSO4•5H2O的质量为1mol×250g/mol=250g,故A错误;
B.125g CuSO4•5H2O的物质的量为$\frac{125g}{250g/mol}$=0.5 mol,故B正确;
C.CuSO4•5H2O的摩尔质量为250g/mol,故C错误;
D.配制100mL 0.1mol/L 硫酸铜溶液,溶质物质的量为0.1L×0.1mol/L=0.01mol,需要CuSO4•5H2O的质量为0.01mol×250g/mol=2.5g,故D错误;
故选B.
点评 本题考查物质的量的计算,为高频考点,把握质量、物质的量的关系为解答的关键,侧重分析与计算能力的考查,注意基本计算公式的应用,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
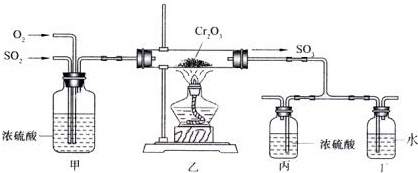
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
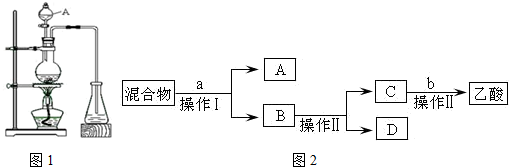
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 明矾净水时使水中悬浮颗粒沉淀 | |
| B. | 清晨树林中的道道光柱 | |
| C. | 雾霾天气打手电能看到明显的光柱 | |
| D. | 澄清石灰水中通入CO2气体,有白色的沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
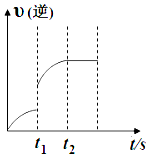 已知反应:C(s)+H2O(g)?CO(g)+H2(g)△H>0,某温度下,向5L密闭容器中加入2mol C(s)与1mol H2O(g),t1s时,CO的物质的量为0.20mol,到第t2s时恰好达到平衡,此时CO的物质的量为0.35mol,下列说法正确的是( )
已知反应:C(s)+H2O(g)?CO(g)+H2(g)△H>0,某温度下,向5L密闭容器中加入2mol C(s)与1mol H2O(g),t1s时,CO的物质的量为0.20mol,到第t2s时恰好达到平衡,此时CO的物质的量为0.35mol,下列说法正确的是( )| A. | t1时改变的条件可能是使用催化剂 | |
| B. | t1时改变的条件可能是增大 H2O 浓度 | |
| C. | t1~t2这段时间内的化学反应速率 v(H2O)=$\frac{{t}_{2}-{t}_{1}}{0.15}$ | |
| D. | t2后继续加入 2 mol C(s)平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
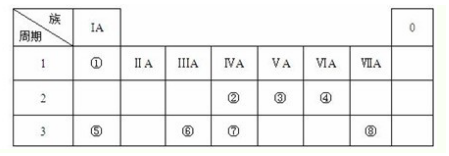
 或
或 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3与过量NaOH溶液反应生成AlO2-,则与过量NH3•H2O反应也生成AlO2- | |
| B. | Al与Fe2O3能发生铝热反应,则与MnO2也能发生铝热反应 | |
| C. | Fe与Cl2反应生成FeCl3,则与I2反应可生成FeI3 | |
| D. | Na2O2与CO2反应生成Na2CO3和O2,则与SO2反应可生成Na2SO3和O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由KClO3变成KCl必须加入还原剂 | |
| B. | 向醋酸溶液中加入少量氢氧化钠溶液,因发生中和反应,溶液的导电能力降低 | |
| C. | 已知氨水的密度比水小,且浓度越大密度越小.则质量分数分别为5%和15%的氨水等体积混合,得到的溶液的质量分数大于10% | |
| D. | 一定条件下,H2与O2的混合气体对氮气的相对密度为1,则H2与O2的物质的量之比为2:13 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com