
分析 钢铁的电化学腐蚀分为析氢腐蚀和吸氧腐蚀,当水膜呈酸性时,发生析氢腐蚀,当水膜呈中性或弱酸性时,发生吸氧腐蚀,据此分析.
解答 解:钢铁的电化学腐蚀分为析氢腐蚀和吸氧腐蚀,当水膜呈中性或弱酸性时,发生吸氧腐蚀,负极上铁失电子放电:Fe-2e-=Fe2+,正极上氧气放电:O2+4e-+2H2O=4OH-,总反应为:2Fe+O2++2H2O=2Fe(OH)2;当水膜呈酸性时,发生析氢腐蚀,负极上铁失电子放电:Fe-2e-=Fe2+,正极上氢离子放电:2H++2e-=H2↑,总反应为:Fe+2H+=Fe2++H2↑,
故答案为:吸氧;O2+4e-+2H2O=4OH-;2Fe+O2++2H2O=2Fe(OH)2;析氢;Fe-2e-=Fe2+;Fe+2H+=Fe2++H2↑.
点评 本题考查了钢铁的析氢腐蚀和吸氧腐蚀的正负极反应和总反应,应注意的是水膜的酸碱性对腐蚀类型的影响.


科目:高中化学 来源: 题型:选择题
| A. | 放电时,负极质量增加 | |
| B. | 放电时,溶液中的BF4-只向正极移动 | |
| C. | 充电时,阳极附近溶液的酸性增强 | |
| D. | 充电时,阴极的电极反应式为Pb2+-2e-=Pb |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 相同时间内CO2转化率 | T1 | T2 | T3 | T4 | T5 |
| 反应Ⅰ | 65% | 77% | 80% | 80% | 66.67% |
| 反应Ⅱ | 56% | 67% | 76% | 80% | 66.67% |
| 反应Ⅲ | 48% | 62% | 72% | 80% | 66.67% |
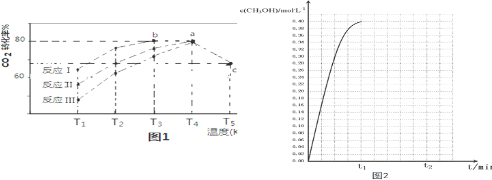
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 低温、高压、催化剂 | B. | 高温、高压 | ||
| C. | 尽可能的高温、高压 | D. | 适宜的温度、高压、催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应时间/min | n(SO2)/mol | n(O2)/mol |
| 0 | 0.10 | 0.060 |
| t1 | 0.012 | |
| t2 | 0.016 |
| A. | 反应在0~t1 min内的平均速率为v(SO3)=0.088/t1 mol•L-1•min-1 | |
| B. | 保持其他条件不变,起始时向容器中充入0.10 mol SO3和0.010 mol O2,到达平衡时,n(SO2)=0.012 mol | |
| C. | 保持其他条件不变,升高温度,平衡时c(SO2)=0.007 0 mol•L-1,则反应的△H>0 | |
| D. | 相同温度下,起始时向容器中充入0.050 mol SO2和0.030 mol O2,达到平衡时SO2转化率大于88% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
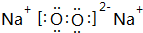 ;属于离子化合物(填“离子”或“共价”);
;属于离子化合物(填“离子”或“共价”); ;属于共价化合物(填“离子”或“共价”);
;属于共价化合物(填“离子”或“共价”);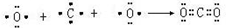 ;
;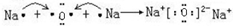 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com