
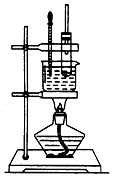
 实验室制备硝基苯的实验装置如图所示,填写下列空白:
实验室制备硝基苯的实验装置如图所示,填写下列空白:分析 (1)混合酸液时,应防止酸液暴沸;
(2)为了使反应在50~60℃下进行,可采用水浴加热;
(3)硝基苯不溶于水;
(4)纯硝基苯密度比水大,为无色油状液体.
解答 解:(1)浓硫酸密度比水大,溶于水放出大量的热,混合酸液时,应防止酸液暴沸,可将浓H2SO4慢慢倒入浓HNO3中,并不断搅拌,故答案为:将浓H2SO4慢慢倒入浓HNO3中,并不断搅拌;
(2)为了使反应在50~60℃下进行,可采用水浴加热,故答案为:水浴加热;
(3)硝基苯不溶于水可用分液漏斗进行分液,故答案为:分液漏斗;
(4)纯硝基苯密度比水大,为无色油状液体,具有苦杏仁味,故答案为:大;苦杏仁.
点评 本题考查硝基苯制备实验的有关判断,该题是基础性试题的考查,试题注重基础,只要是考查学生对硝基苯制备实验的了解掌握程度,以及灵活运用基础知识解决实际问题的能力,有利于培养学生的实验能力,和严禁的逻辑思维能力.


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:选择题
| A. | 充电时阳极反应式为:Zn-2e-+2OH-=Zn(OH)2 | |
| B. | 0.1molK2FeO4发生反应,转移电子数约为1.806×1024 | |
| C. | 充电时K2FeO4发生氧化反应 | |
| D. | 放电时正极反应为:2FeO42-+6e-+8H2O=2Fe(OH)3+10OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 氮氧化物是大气污染物之一,目前,消除氮氧化物的方法有多种.
氮氧化物是大气污染物之一,目前,消除氮氧化物的方法有多种.| 化学键 | O═O | C═O | C≡O |
| 键能(Kj/moL) | 497 | 803 | 1072 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该物质有三种官能团,该物质自身能发生酯化反应 | |
| B. | 该物质能使酸性高锰酸钾溶液和溴水褪色,它们的反应原理相同 | |
| C. | 该物质能通过两种方式的反应生成两种高分子物质 | |
| D. | 1mol该物质能够消耗2mol金属钠同时放出1mol氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操 作 | 现 象 | 解释、结论 |
| A | 把过量的Fe粉中加入硝酸中充分反应,滴入KSCN溶液 | 溶液呈红色 | 稀硝酸将Fe氧化为Fe3+ |
| B | 向饱和Na2CO3溶液中通入足量CO2 | 溶液变浑浊 | 析出了Na2CO3晶体 |
| C | 定容时不小心加水超过容量瓶的刻度线,立即用滴管吸去多余的部分 | 液体凹液面与刻度线相平 | 配制溶液的浓度不受影响 |
| D | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 有机物 | 氢氧化钠 | 银氨溶液 | 新制氢氧化铜 | 金属钠 |
| A | 发生中和反应 | 不反应 | 溶解 | 放出氢气 |
| B | 不反应 | 发生银镜反应 | 生成红色沉淀 | 放出氢气 |
| C | 不反应 | 发生银镜反应 | 生成红色沉淀 | 不反应 |
| D | 发生水解反应 | 不反应 | 不反应 | 不反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 粗硅$→_{高温}^{Cl_{2}}$ SiCl4$→_{高温}^{H_{2}}$ Si | |
| B. | Mg(OH)2$\stackrel{盐酸}{→}$ MgCl2(aq)$\stackrel{电解}{→}$ Mg | |
| C. | Fe2O3$\stackrel{盐酸}{→}$ FeCl3(aq)$\stackrel{蒸发}{→}$ 无水FeCl3 | |
| D. | AgNO3(aq)$\stackrel{NH_{3}•H_{2}O}{→}$ OH(aq)$→_{△}^{蔗糖}$ Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO32-→SO42- | B. | CO32-→CO2 | C. | Fe3+→Fe2+ | D. | MnO4-→Mn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com