



 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
(2008?南京一模)下列各组物质中,气体X和气体Y在通常条件下同时通入盛有溶液Z的洗气瓶中(如图所示),一定没有沉淀生成的是( )
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 代号 | 物质 | 结构式 | 水中溶解度/g (25℃) |
熔点/℃ | 沸点/℃ |
| A | 邻-硝基苯酚 |  |
0.2 | 45 | 100 |
| B | 对-硝基苯酚 | 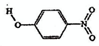 |
1.7 | 114 | 295 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com