
����Ŀ��ij�¶��£���2L�����ܱ������г���1.0mol A��1.0mol B��������Ӧ��A��g��+B��g��C��g������һ��ʱ���ﵽƽ�⣮��Ӧ�����вⶨ�IJ������ݼ���������˵����ȷ���ǣ�������
t/s | 0 | 5 | 10 | 20 | 30 |
n��A��/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
A.��Ӧ��ǰ5 s��ƽ������v��A��=0.03 molL��1s��1
B.�ﵽƽ��ʱ��B��ת����Ϊ80%
C.��ͬ�¶��£�����ʼʱ�������г���2.0 mol C����ﵽƽ��ʱC��Ũ��С��0.2 molL��1
D.��ͬ�¶��£���ʼʱ�������г���0.20 mol A ,0.20 mol B��1.0 mol C����Ӧ�ﵽƽ��ǰv��������v���棩
���𰸡�D
��������A����Ӧ��ǰ5 s��ƽ������v��A��= ![]() =
= ![]() =0.015 molL��1s��1����A���������⣻
=0.015 molL��1s��1����A���������⣻
B�����ݱ�������֪��20sʱ�÷�Ӧ�ﵽƽ��״̬�����ݷ���ʽ֪��n��A��=��n��B��=��1.0��0.80��mol=0.20mol��ת����= ![]() ��100%=
��100%= ![]() ��100%=20%����B���������⣻
��100%=20%����B���������⣻
C������1.0mol A��1.0mol B��ƽ��ʱn��A��=n��B��=0.80mol������n��C��=��n��A��=0.20mol����c��A��=c��B��= ![]() =0.40mol/L��c��C��=
=0.40mol/L��c��C��= ![]() =0.10mol/L����ѧƽ�ⳣ��K=
=0.10mol/L����ѧƽ�ⳣ��K= ![]() =0.625��
=0.625��
����ʼʱ�������г���2.0 mol C����ʣ��C�����ʵ���Ϊxmol��
A��g��+ | B��g�� | C��g�� | |
��ʼ��mol�� | 0 | 0 | 2.0 |
ת����mol�� | 2.0-x | 2.0-x | 2.0-x |
ƽ�⣨mol�� | 2.0-x | 2.0-x | x |
ƽ��ʱc��A��=c��B��= ![]() mol/L��c��C��=
mol/L��c��C��= ![]() mol/L��
mol/L��
�¶���ͬ��ѧƽ�ⳣ����ͬ������  =0.625��
=0.625��
x=1.6��
���Դﵽƽ��ʱC��Ũ��= ![]() =0.8mol/L����C���������⣻
=0.8mol/L����C���������⣻
D���¶���ͬ��ƽ�ⳣ�����䣬���¶���ƽ�ⳣ��K= ![]() =
= ![]() =0.625����ʼʱ�������г���0.20mol A��0.20mol B��1.0mol C����ʱŨ����Qc=
=0.625����ʼʱ�������г���0.20mol A��0.20mol B��1.0mol C����ʱŨ����Qc= ![]() =50��K���ʷ�Ӧ���淴Ӧ���У���Ӧ�ﵽƽ��ǰv��������v���棩����D�������⣬
=50��K���ʷ�Ӧ���淴Ӧ���У���Ӧ�ﵽƽ��ǰv��������v���棩����D�������⣬
�ʴ�Ϊ��D��
A.����![]() ���㷴Ӧ���ʣ�
���㷴Ӧ���ʣ�
B.���ݻ�ѧ����ʽ����B��ת�����ʵ�����Ȼ��������ת���ʣ�
C.��������ʽ���㼴�ɣ�
D.����Ũ���غ�ƽ�ⳣ������Դ�С�ж�ƽ���ƶ��ķ���.



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����ǣ�C6H12O6���������ڷ�����ѧ��Ӧ����CO2��H2O������������ ��ȷ���ǣ� ��
A.�÷�Ӧ��һ���ȷ�Ӧ
B.�÷�Ӧ��������������ԭ��Ӧ
C.�÷�Ӧһ����������ԭ��Ӧ��ͬʱҲ��һ�����ȷ�Ӧ
D.�÷�Ӧ��һ��Ҫ�������μ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ҹ���ѧ�ҷ������ɳ����-������̼��ء�����ͼ�����ŵ�ʱ����ܷ�ӦΪ��4Na+3CO2 = 2Na2CO3+C������˵����������

A. ��ع����¶ȿ�����200������
B. ��װ�ÿ��Խ���ѧ��ת��Ϊ����
C. �ŵ�ʱ��Na+�������ƶ�
D. �ŵ�ʱ�������ĵ缫��ӦΪ��4Na++3CO2+4e��=2Na2CO3+C
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ɳ�����Ԫ�غͶ�����Ԫ�ع�ͬ���ɵ����ǣ� ��
��0�� ������ �۸��� �ܵڢ��壮
A.�٢�
B.�٢�
C.�ڢ�
D.�ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Դ�ı��⣬���зḻ�Ļ�ѧԪ�ء�
��1���ڵ�ⱥ��ʳ��ˮ��ʵ���У���������ļ��鷽����________________________��
��2��Ŀǰ�Ӻ�ˮ�����壨Br 2 �����������²��衣
����Ũ���ĺ�ˮ��ͨ��Cl2������ˮ�е� Br�� ����Ϊ Br2 ��
�����ȿ����� Br 2 ��������Һ�д���������Ũ Na 2 CO 3 ��Һ���գ�ת��Ϊ NaBr��NaBrO 3��CO2 ������1 moL Br 2 ������ Na2CO3 ________moL��
���ٽ����û����Һ��ϡ�����ữ���õ�Ũ�Ƚϸߵ���ˮ����ƽ�÷�Ӧ�����ӷ���ʽ��
____Br�� +____ BrO3�� +____H + ��____ Br2 +____H2O
��3������Ҫ�Ӻ�������ȡ��ij������ȤС���ͬѧ�ú���Ϊԭ���Ƶ�������ˮ֮������CCl4�ӵ�ˮ����ȡ�⣬���������CCl4�ӵ�ˮ����ȡ���ԭ���ǣ�___________��
��4��ͬ��ͬŨ�ȵ�Na2CO3��Һ��NaHCO3��Һ��PH��С˳��Ϊ________ ��NaHCO3��Һ�е�����������������Һ����Һ��c(CO32-)_______(������С)������ƽ�����۽��ͷ������ֱ仯��ԭ��____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)ԭ��ؿɽ���ѧ��ת��Ϊ���ܡ���Fe��Cu��Ũ���ṹ��ԭ��أ�������_____(����Cu������Fe��)����Zn��Ag��ϡ���ṹ��ԭ��أ���������_____��Ӧ(������������ԭ��)��������ͬ��ͭ����п���õ������Ӻ����CuSO4��Һ�У�һ��ʱ���ȡ��ϴ�����������������������Ϊ12.9g��������ͨ���ĵ��ӵ����ʵ�����____mol��
(2)������������(KOHΪ�����)ȼ�ϵ��(��������Ϊ������Ҫ�ɷ�)������ת���ʸߡ���֪������Ч�ʿ��õ�λ������ȼ���ṩ�ĵ�������ʾ��������������(KOHΪ�����)ȼ�ϵ�ء���������������(KOHΪ�����)ȼ�ϵ��(��������Ϊ������Ҫ�ɷ�)�ĵ���Ч��֮��Ϊ____��
(3)һ���¶��£���3molA�����1molB����ͨ��һ�ݻ��̶�Ϊ2L���ܱ������У��������·�Ӧ��3A(g)+B(g)![]() xC(g)����Ӧ1minʱ���ʣ��1.8molA��C��Ũ��Ϊ0.4mol/L��xΪ_____������Ӧ��2min�ﵽƽ�⣬ƽ��ʱC��Ũ��____0.8mol/L(�������ڣ�С�ڻ������)������֪��ƽ��ʱ���������ڻ��������ѹǿΪp�����������ʼѹǿΪp0������p0��p����ʾ��ƽ��ʱ��Ӧ��A��ת����Ϊ________��
xC(g)����Ӧ1minʱ���ʣ��1.8molA��C��Ũ��Ϊ0.4mol/L��xΪ_____������Ӧ��2min�ﵽƽ�⣬ƽ��ʱC��Ũ��____0.8mol/L(�������ڣ�С�ڻ������)������֪��ƽ��ʱ���������ڻ��������ѹǿΪp�����������ʼѹǿΪp0������p0��p����ʾ��ƽ��ʱ��Ӧ��A��ת����Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������£���Ӧ����һ���ܴ���������ǣ�������
A.��0.1mol/LNaHCO3��Һ�У�Al3+��NH4+��SO42����NO3��
B.�����£� ![]() =0.1mol/L����Һ�У�K+ �� Cl�� �� Fe2+ �� NO3��
=0.1mol/L����Һ�У�K+ �� Cl�� �� Fe2+ �� NO3��
C.ʹ���ȱ�����Һ�У�NH4+ �� Cl�� �� SO2�� �� Mg2+
D.25��ʱ��ˮ�������c��H+��=1��10��13mol/L��K+ �� Ba2+ �� NO3�� �� S2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Һ��ͨ����������������ͬʱ�õ������ԭ����ͼ��ʾ��ͼ��HA��ʾ������ӣ�A����ʾ��������ӣ�������˵����ȷ���ǣ� ��
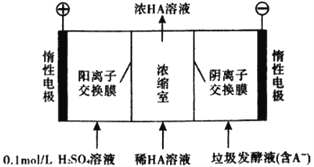
A. ͨ�����������pH����
B. ���ӴӸ������������Һ�ص�����
C. ͨ���A��ͨ�������ӽ���Ĥ����������Ũ����
D. ����·��ͨ��2 mol���ӵĵ���ʱ������1 mol��O2����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com