
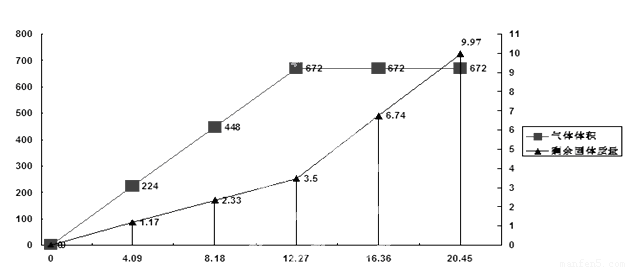
为检验一批因露置而部分变质的Ba(OH) 2药品的成分,某化学探究性学习小组设计了方案对其进行分析:将20.45g药品分成五等分,逐渐加入100mL1 mol/L的盐酸中,并充分搅拌,测得生成气体的体积(已换算为标准状况下)、剩余固体的量与固体加入量的关系如图所示。考虑到某地附近为硫酸工业区,该小组同学判断此药品可能含三或四种成分。
(1) 写出硫酸工业尾气与过量的Ba(OH) 2反应的离子方程式:????????????????????????
(2)提出以下三种合理假设:(已知在空气中Ba(OH) 2很难生成酸式盐)
假设一:药品成分为Ba(OH) 2和BaSO4、BaSO3;假设二:药品成分为Ba(OH) 2和________________;
假设三:药品成分为Ba(OH) 2和________________。
(3)实验验证:为确定该药品的成分,该小组利用上述实验中生成的气体,选择适当的试剂进行探究,请设计合理方案填入下表:
实验操作 | 预期实验现象和结论 |
| 若____________________,假设一成立;
若____________________,假设二成立;
若____________________,假设三成立。 |
(4)问题讨论:若经试验验证,此药品为四种成分混合物,该小组同学认为由上述曲线可知,当所加固体质量为12.27 g时,药品成分与盐酸刚好完全反应,你认为该组同学的判断是否正确______。(填“是”或者“否”)
(1)Ba2++2OH-+SO2=BaSO3↓+H2O?
(2)假设二: BaSO4、BaCO3?????? 假设三:BaSO4、BaCO3、BaSO3
(3)
实验操作? | 预期实验现象和结论 |
①品红溶液、②足量的酸性高锰酸钾溶液、③澄清石灰水
| 若_①褪色,②颜色变浅,③无明显现象,假设一成立; 若①和②无明显现象,③变浑浊,假设二成立; 若①褪色,②颜色变浅,③变浑浊,假设三成立。 |
(4)否
【解析】
试题分析:(1)硫酸工业尾气主要含有SO2,它与过量的Ba(OH) 2反应的离子方程式为Ba2++2OH-+SO2= BaSO3↓+H2O。(2)根据二者发生的反应和已知的假设情况可以确定假设二BaSO4、BaCO3 ;假设三BaSO4、BaCO3、BaSO3。(3)把反应产生的气体①分别通入到品红溶液中,②足量的酸性高锰酸钾溶液、③澄清石灰水。若品红溶液褪色,就证明气体中含有含有SO2,原固体中含有BaSO3;足量的酸性高锰酸钾溶液中,溶液颜色变浅,就证明产生了SO2,原固体中含有BaSO3;澄清石灰水无明显现象,就证明无CO2产生,原固体中没有BaCO3.即证明假设一成立。若①和②无明显现象,③澄清石灰水变浑浊,则证明假设二成立;若①品红溶液褪色,②酸性高锰酸钾溶液颜色变浅,③澄清石灰水变浑浊,则证明假设三成立。(4)由图像可知放出的气体体积最大值是672ml。在加入固体为12.27g时,气体体积为672ml,可能是药品成分与盐酸刚好完全反应,也可能在质量小于12.27g时已经反应完全。放出气体的体积就已经达到最大值。因此该组同学的说法是有偏差的。
考点:考查实验方案的设计及评价的知识。


科目:高中化学 来源: 题型:
 乙二酸俗名草酸,某化学学习小组的同学欲探究测定草酸晶体(H2C2O4?xH2O)中x值.通过查阅资料该小组同学通过网络查询得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:
乙二酸俗名草酸,某化学学习小组的同学欲探究测定草酸晶体(H2C2O4?xH2O)中x值.通过查阅资料该小组同学通过网络查询得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:素质教育新教案 高中化学·二年级·第二册(上册) 题型:022
草酸晶体的组成可表示为H2C2O4·xH2O为测定x值做了如下实验:
(1)称取W克纯草酸晶体,将其溶于水配制成100.00 mL溶液,作为待测液;
(2)量取25.0 mL待测液放入锥形瓶中,再加入适量的稀H2SO4;
(3)用浓度为a mol/L的KMnO4标准溶液进行滴定,发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
请回答:
(1)滴定时,KMnO4标准溶液因装在________式滴定管中,是因为________.
(2)若滴定时所用的KMnO4溶液因久置而浓度变小,则由此测得x值会________(填偏大、偏小、不变)
(3)假定滴定到达终点时用去V mL KMnO4溶液,则待测草酸溶液的物质的量浓度为________ mol/L,由此计算出的草酸晶体的化学式中的x=________.
查看答案和解析>>
科目:高中化学 来源: 题型:
草酸晶体的组成可表示为H2C2O4?xH2O,为测定x的值进行下述实验。
A.称取mg纯草酸晶体,将其配成100mL溶液作为待测液。
B.取25mL待测液置于锥形瓶中,再加入适量的稀H2SO4,用浓度为amol/L的KMnO4溶液滴定,滴定所发生的反应为2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O。
试回答:
(1)实验A欲配制准确浓度的草酸待测液,必须使用的仪器是_______。
(2)用KMnO4溶液进行滴定时,KMnO4溶液应装在______中,操作时用______手拿锥形瓶。
(3)若滴定时所用的KMnO4溶液因久置而浓度变小,则所测定的x值将_______。
(4)假定滴定中共用去KMnO4溶液VmL,则待测草酸溶液的物质的量浓度为______,由此计算出草酸晶体中结晶水x的值为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com