
 ��ͼ��ʾ�и����ʾ�Ϊ��ѧ��ѧ�г��������ʣ�����֮������ͼת����ϵ������A��C��Ϊ�������ʣ�D����ɫ��Ӧ�ʻ�ɫ��C��ˮ��Ӧ��������D������������Ȼ����������壻E��һ��������������ܸ�NaOH��Ӧ���ܸ����ᷴӦ������Ӧ���������ɵ�ˮ��������������ȥ��
��ͼ��ʾ�и����ʾ�Ϊ��ѧ��ѧ�г��������ʣ�����֮������ͼת����ϵ������A��C��Ϊ�������ʣ�D����ɫ��Ӧ�ʻ�ɫ��C��ˮ��Ӧ��������D������������Ȼ����������壻E��һ��������������ܸ�NaOH��Ӧ���ܸ����ᷴӦ������Ӧ���������ɵ�ˮ��������������ȥ��


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A��8Al+3Fe3O4
| ||||
B��2Mg+CO2
| ||||
C��N2+3H2
| ||||
D��SiO2+CaO
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�����³�ѹ�£�32 g O2�к��еķ�����ΪNA |
| B�����³�ѹ�£�22.4 L H2O�к��еķ�����ΪNA |
| C��23 g�������к��еĵ�����ΪNA |
| D��100 mL 1 mol?L-1K2SO4��Һ�к��еļ�������Ϊ0.1NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
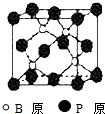 ����BP���͵�����BN�����ܵ��߶ȹ�ע����ĥͿ�ϣ����ǵĽṹ���ƣ�ͼΪ������ṹ����С���ظ��ṹ��Ԫ������������廯������廯���������и��·�Ӧ�ϳɣ�BBr3+PBr3+3H2=BP+6HBr��
����BP���͵�����BN�����ܵ��߶ȹ�ע����ĥͿ�ϣ����ǵĽṹ���ƣ�ͼΪ������ṹ����С���ظ��ṹ��Ԫ������������廯������廯���������и��·�Ӧ�ϳɣ�BBr3+PBr3+3H2=BP+6HBr��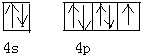 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��CaCO3=CaO+CO2�� |
| B��SO2+H2O=H2SO3 |
| C��Na2CO3+2HCl=2NaCl+CO2��+H2O |
| D��CH4+2O2=CO2+2H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A������Ũ�� |
| B����ˮϡ�� |
| C������CuCl2 ���� |
| D������ʳ�ξ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��Ϩ��ƾ���ʱ�����촵�� |
| B������ҩƷʱ�������Ӽ�ȡ���� |
| C����Ӧ��û�����ҩƷ��Ӧ�����Ż�ԭ�Լ�ƿ�У������˷� |
| D�����Թ���Һ�����ʱ���Թܿڶ������˵ķ��� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com