
【题目】下列有关非金属及其化合物的说法正确的是( )
A. 硅酸可使紫色石蕊试液变红色
B. 二氧化硫通入紫色石蕊试液中.试液先变红后褪色
C. 可用锌粒与稀硝酸反应制备氢气
D. 液溴易挥发,所以存放液溴的试剂瓶中应加水封保存
 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案科目:高中化学 来源: 题型:
【题目】数十年来,化学工作者对碳的氧化物做了广泛深入的研究并取得了一些重要成果。在高温高压下CO具有极高的化学活性,能与多种单质或化合物反应。
(1)工业上常采用水蒸气喷到灼热的炭层上实现煤的气化(制得CO、H2),该反应的化学方程式是 。
(2)上述煤气化过程中需向炭层交替喷入空气和水蒸气,喷入空气的目的是 ;反应生成的气体在加热、催化剂作用条件下可合成液体燃料甲醇,该反应的化学方程式为 。
(3)一定条件下,CO与H2可合成甲烷,反应方程式为:CO(g)+3H2(g)![]() CH4(g)+H2O (g)该条件下,该反应能够自发进行的原因是 。
CH4(g)+H2O (g)该条件下,该反应能够自发进行的原因是 。
(4)CO—空气燃料电池中使用的电解质是搀杂了Y2O3的ZrO2晶体,它在高温下能传导O2-。该电池正极的电极反应式为 。
(5)工业上可通过甲醇羰基化法制取甲酸甲酯,反应方程式为:
CH3OH(g)+CO(g)![]() HCOOCH3(g) ΔH =-29.1 kJ·mol-1
HCOOCH3(g) ΔH =-29.1 kJ·mol-1
科研人员对该反应进行了研究,部分研究结果如下:
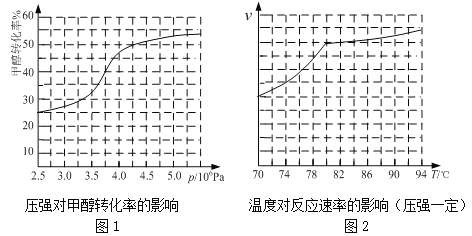
①根据反应体系的压强对甲醇转化率的影响并综合考虑生产成本因素,工业制取甲酸甲酯应选择的压强为 。
a.3.5×106Pa b.4.0×106Pa c.5.0×106Pa
②实际工业生产中采用的温度是 ,其理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某+2价离子的电子排布式为1s22s22p43s23p43d10,该元素在周期表中所属的族是( )
A. ⅡA B. ⅡB C. ⅤⅡ D. ⅠB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程中,没有明显实验现象的是( )
A.向Fe(NO3)2溶液中滴加稀硫酸 B.将HCl通入NaAlO2溶液中
C.向碳酸氢钠溶液中滴加氢氧化钠溶液 D.加热溶有SO2的品红溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是一种气态烃,标况下的密度为1.25g/L,现以A为主要原料合成一种具有果香味的物质E,其合成路线如下图所示。
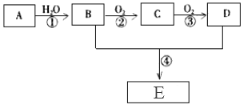
(1)写出A的结构简式 。
(2)B、D分子中所含官能团的名称分别是 、 。
(3)物质B可以直接氧化为D,需要加入的试剂是 。
(4)写出下列反应的化学方程式:
反应②的化学方程式: ;反应类型: 。
反应④的化学方程式: ;反应类型: 。
(5)B可由含淀粉的农产品如玉米、小麦、薯类等经发酵、蒸馏而得。请写出淀粉水解的化学方程式。
____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于常见有机物的说法正确的是
A.乙烯和苯都能和溴水发生化学反应而使溴水褪色
B.乙烷可使酸性高锰酸钾溶液褪色
C.糖类和蛋白质都是高分子化合物
D.乙酸和油脂都能与氢氧化钠溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硅藻土为载体的五氧化二钒(V2O5)是接触法生产硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:
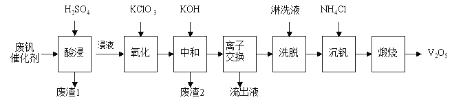
回答下列问题:
(1)“酸浸”时V2O5转化为VO2+,反应的离子方程式为___________,同时V2O4转成VO2+。“废渣1”的主要成分是__________________。
(2)“氧化”中欲使3 mol的VO2+变为VO2+,则需要氧化剂KClO3至少为____________mol。
(3)“中和”作用之一是使钒以V4O124-形式存在于溶液中。“废渣2”中含有_____________。
(4)“离子交换”和“洗脱”可简单表示为:4ROH+![]()
![]() R4V4O12+4OH(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈___________性(填“酸”“碱”“中”)。
R4V4O12+4OH(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈___________性(填“酸”“碱”“中”)。
(5)“流出液”中阳离子最多的是________。
(6)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】日常生活中硫、氮氧化物的排放可能导致“酸雨”。下列活动会导致“酸雨”危害加剧的是( )
A.种草植树,建设“海绵”城市 B.推广使用电动车
C.普及燃煤供暖,减少石油依赖 D.开发太阳能照明
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮的固定具有重要意义。
(1)雷雨天气中发生自然固氮后,氮元素转化为 而存在于土壤中.处于研究阶段的化学固氮新方法是N2在催化剂表面与水发生如下反应:
2N2(g)+6H2O(l)=4NH3(g)+3O2(g)△H K ①
已知:N2(g)+3H2(g)=2NH3(g)△H1=﹣92.4kJmol﹣1 K1 ②
2H2(g)+O2(g)=2H2O(l)△H2=﹣571.6kJmol﹣1 K2 ③
则△H= ;K= (用K1和 K2表示)。
(2)在四个容积为2L的密闭容器中,分别充入1mol N2、3mol H2O,在催化剂条件下进行反应①3小时,实验数据见下表:
序号 | 第一组 | 第二组 | 第三组 | 第四组 | ||||||||||
t/℃ | 30 | 40 | 50 | 80 | ||||||||||
NH3生成量/(10﹣6mol) | 4.8 | 5.9 | 6.0 | 2.0 | ||||||||||
下列能说明反应①达到平衡状态的是 (填字母)。K]
a.NH3和O2的物质的量之比为4:3
b.反应混合物中各组份的质量分数不变
c.单位时间内每消耗1molN2的同时生成2molNH3
d.容器内气体密度不变
若第三组反应3h后已达平衡,第三组N2的转化率为 ;与前三组相比,第四组反应中NH3生成量最小的原因可能是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com