
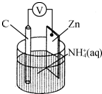
| A. | 碳电极上发生还原反应 | |
| B. | Zn极上发生还原反应 | |
| C. | 常见锌锰干电池为二次电池 | |
| D. | 负极上发生的反应为2NH4++2e-═2NH3↑+H2↑ |
分析 该装置是原电池,根据电池反应式知,放电时,Zn元素化合价由0价变为+2价、H元素化合价由+1价变为0价,所以Zn是负极、C是正极,负极反应式为Zn-2e-=Zn2+,正极反应式为2NH4++2e-=2NH3↑+H2↑,以此解答该题.
解答 解:A.放电时,Zn元素化合价由0价变为+2价、H元素化合价由+1价变为0价,所以Zn是负极、C是正极,正极发生还原反应,故A正确;
B.Zn电极上失电子发生氧化反应,电极反应式为Zn-2e-=Zn2+,故B错误;
C.常见锌锰干电池不能充放电,所以属于一次电池,故C错误;
D.Zn是负极、C是正极,正极反应式为2NH4++2e-=2NH3↑+H2↑,负极反应式为Zn-2e-=Zn2+,故D错误;
故选A.
点评 本题考查化学电源新型电池,明确正负极与得失电子关系是解本题关键,知道各个电极上发生的反应及反应类型,难点是正极反应式的书写,题目难度不大.


科目:高中化学 来源: 题型:解答题
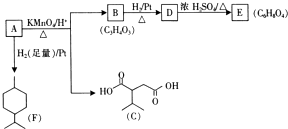
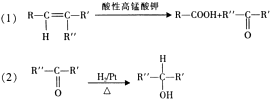
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na与水反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | FeCl3溶液腐蚀铜印刷电路板:Fe3++Cu═Fe2++Cu2+ | |
| C. | 明矾溶液中加入过量NaOH溶液:Al3++4OH-═AlO2-+2H2O | |
| D. | 盛放NaOH溶液的试剂瓶不能使用玻璃塞:SiO2+2OH-═SiO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 水合铜离子的模型如图1所示,1个水合铜离子中有4个配位键 | |
| B. | CaF2晶体的晶胞如图2所示,每个CaF2晶胞平均占有4个Ca2+,4个F- | |
| C. | H原子的电子云图如图3所示,H原子核外大多数电子在原子核附近运动 | |
| D. | 原子堆积模型如图4,可表示Mg原子的堆积方式 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.2gCH3OH含有的化学键数为0.4NA | |
| B. | 0.05molH2O2中含有的阴离子数为0.05NA | |
| C. | 3mol单质Fe与足量水蒸气在一定条件下反应失去9NA 个电子 | |
| D. | 0.2gD216O中含有的质子数、中子数和电子数均为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com