
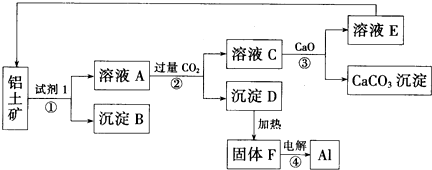
分析 铝土矿(主要成分含氧化铝、氧化铁)加入氢氧化钠,氧化铁不和碱反应,氧化铝可与氢氧化钠反应生成偏铝酸钠和水;过滤后得到的沉淀B为氧化铁,滤液A中含氢氧化钠和偏铝酸钠;通入二氧化碳,二氧化碳和偏铝酸钠反应生成氢氧化铝沉淀和碳酸钠,二氧化碳和氢氧化钠反应生成碳酸钠,过滤得到氢氧化铝沉淀和碳酸钠溶液;灼烧氢氧化铝得到氧化铝和水,电解氧化铝得到铝和氧气;碳酸钠溶液和氧化钙反应生成碳酸钙和氢氧化钠,氢氧化钠用来碱浸;灼烧碳酸钙得到氧化钙和二氧化碳,二氧化碳和氧化钙循环使用;
(1)铝土矿(主要成分含氧化铝、氧化铁)加入氢氧化钠,氧化铁不和碱反应,氧化铝可与氢氧化钠反应生成偏铝酸钠和水;
(2)电解氧化铝需要破坏离子键,需要吸收大量的能量;
三氧化二铁不溶于氢氧化钠,过滤得到固体为三氧化二铁,为红棕色固体,可用作染料;
(3)依据电解氧化铝的方程式为:2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑,根据铝和转移电子之间的关系式计算;
(4)煅烧碳酸钙得到CaO和CO2,二者能循环利用;
(5)偏铝酸钠溶液通入过量的二氧化碳反应生成氢氧化铝和碳酸氢钠.
解答 解:(1)铝土矿(主要成分含氧化铝、氧化铁)加入氢氧化钠,氧化铁不和碱反应,氧化铝可与氢氧化钠反应生成偏铝酸钠和水;电解氧化铝需要破坏离子键,需要吸收大量的能量;
故答案为:NaOH; ④;
(2)铝土矿(主要成分含氧化铝、氧化铁)加入氢氧化钠,氧化铁不和碱反应,氧化铝可与氢氧化钠反应生成偏铝酸钠和水;过滤后得到的沉淀为氧化铁;三氧化二铁为红棕色,可以做颜料;
故答案为:Fe2O3 颜料等;
(3)电解氧化铝的方程式为:2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑,设得到铝的质量为x,
2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑ 转移电子
108g 12mol
x 6mol
解得x=54g;
故答案为:54g;
(4)煅烧碳酸钙得到CaO和CO2,B生成沉淀需要二氧化碳、碳酸钠转化为碳酸钙需要CaO,所以CaO和CO2能循环利用,
故答案为:CaO和CO2.
(5)偏铝酸钠溶液通入过量的二氧化碳反应生成氢氧化铝和碳酸氢钠,离子方程式:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-;
故答案为:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-;
点评 本题考查物质分离和提纯,侧重考查学生分析及知识运用能力,明确物质性质及基本操作方法、反应原理即可解答,知道常见元素化合物知识及常见离子检验方法,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
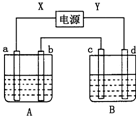 如图所示装置,X、Y为电源的两极,a、b均为石墨电极,c为铜电极,d为铁电极,A槽中盛装饱和食盐水,B槽中盛装CuCl2溶液.通电一段时间后,发现d电极上覆盖一层红色物质.
如图所示装置,X、Y为电源的两极,a、b均为石墨电极,c为铜电极,d为铁电极,A槽中盛装饱和食盐水,B槽中盛装CuCl2溶液.通电一段时间后,发现d电极上覆盖一层红色物质.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
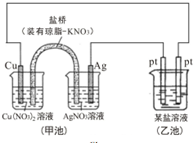
| A. | 实验过程中,甲池左侧烧杯中NO3-的浓度增大 | |
| B. | 图中甲池中的盐桥可以是装琼脂的饱和KCl溶液 | |
| C. | 若乙池为Na2SO4溶液,一段时间后,右边Pt极上产生了0.672L气体(标准状况),则甲池中Ag电极质量增加12.96g | |
| D. | Cu电极发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| A | 比较苯酚和乙醇中羟基氢的活泼性强弱 | 用氢氧化钠分别与苯酚和乙醇反应 |
| B | 证明HOCH2CH2CHO中含有醛基 | 滴入KMnO4酸性溶液 |
| C | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变成红色 |
| D | 检验乙醇与浓硫酸共热是否产生乙烯 | 将乙醇与浓硫酸共热至170℃,所得气体通入酸性高锰酸钾溶液中,观察溶液是否褪色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
| 元素 | O | S | Se | Te |
| 单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子最外层电子数:X>Y>Z | B. | 原子序数:X>Y>Z | ||
| C. | 单质沸点:Z>Y>X | D. | 离子半径:X2->Y+>Z- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH-CH=CH2 | B. | 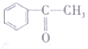 | C. | ClCH=CHCHO | D. | 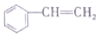 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2的电子式: | B. | Cl-的结构示意图: | ||
| C. | 乙醇的结构式:CH3CH2OH | D. | 乙烯的结构简式:CH2CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图1是硫酸试剂瓶标签上的部分内容.现实验室需要240ml 4.6mol/L的稀硫酸用该硫酸配置,
如图1是硫酸试剂瓶标签上的部分内容.现实验室需要240ml 4.6mol/L的稀硫酸用该硫酸配置,查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com